题目内容
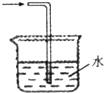
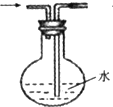
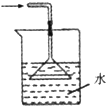
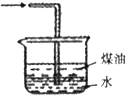
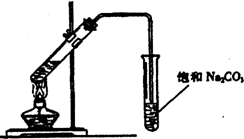
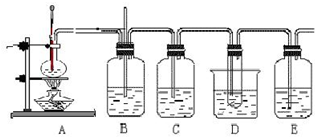
乙烯与液溴作用制取1,2-二溴乙烷的装置如下.(D中试管里所装物质为液溴)
1,2-二溴乙烷的主要物理性质见下表:
(1)A是乙醇制备乙烯的反应装置图,B、D中所盛都是水,其中D装置中水的作用是______.
(2)C和E中,所盛都是NaOH溶液,它们的作用分别是:C______;E______.
(3)写出以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷的主要化学反应方程式______;______.
1,2-二溴乙烷的主要物理性质见下表:
| 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 9.79 | 131.4 | 2.18 | 难溶于水,易溶于醇、醚等 |
(2)C和E中,所盛都是NaOH溶液,它们的作用分别是:C______;E______.
(3)写出以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷的主要化学反应方程式______;______.

(1)A是乙醇制备乙烯的反应装置图,是利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,CH3CH2OH
CH2=CH2↑+H2O,浓硫酸具有强氧化性,能氧化乙醇,能将乙醇氧化成二氧化碳,自身被还原成二氧化硫,C所盛是NaOH溶液,吸收乙烯中混有的SO2、CO2,由乙烯和溴发生加成反应生成1,2-二溴乙烷,溴易挥发,B,所以D装置中水的作用是冷却液溴,冷却可避免溴的大量挥发,
故答案为:冷却液溴;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,SO2+2H2O+Br2=H2SO4+2HBr中S元素的化合价升高,二氧化硫被氧化,二氧化碳、二氧化硫能和氢氧化钠溶液反应,乙烯与氢氧化钠溶液不反应,溴易挥发,挥发到空气中会污染空气,常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:吸收乙烯中混有的SO2、CO2;吸收逸出的溴蒸气,防止污染空气;
(3)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,反应为:CH3CH2OH
CH2=CH2↑+H2O;乙烯分子中含有不饱和键,它和溴水发生加成反应生成无色的1,2-二溴乙烷,即CH2=CH2+Br-Br→CH2Br-CH2Br,
故答案为:CH3CH2OH
CH2=CH2↑+H2O;CH2=CH2+Br-Br→CH2Br-CH2Br.
| 浓硫酸 |
| 170℃ |
故答案为:冷却液溴;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,SO2+2H2O+Br2=H2SO4+2HBr中S元素的化合价升高,二氧化硫被氧化,二氧化碳、二氧化硫能和氢氧化钠溶液反应,乙烯与氢氧化钠溶液不反应,溴易挥发,挥发到空气中会污染空气,常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:吸收乙烯中混有的SO2、CO2;吸收逸出的溴蒸气,防止污染空气;
(3)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,反应为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |

练习册系列答案
相关题目