题目内容
 已知CsCl晶体的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
已知CsCl晶体的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )分析:利用均摊法确定该立方体中含有的离子,根据ρV=
计算相对分子质量.
| M |
| NA |
解答:解:该立方体中含1个氯离子,Cs+个数=8×
=1,根据ρV=
知,M=ρVNA=ρa3NA,
摩尔质量在数值上等于其相对分子质量,所以其相对分子质量是ρa3 NA,故选A.
| 1 |
| 8 |
| M |
| NA |
摩尔质量在数值上等于其相对分子质量,所以其相对分子质量是ρa3 NA,故选A.
点评:本题考查了相对分子质量的计算,明确该立体中含有的阴阳离子个数是解本题的关键,根据摩尔质量与密度、体积和NA之间的关系来分析解答即可,难度不大.

练习册系列答案
相关题目
(1)下列有关晶体的叙述中错误的是
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图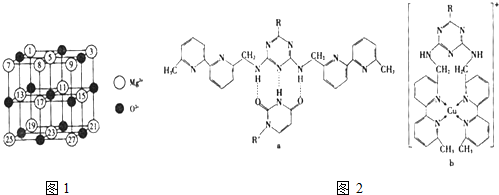
中错误: .(用文字表述)
(3)第三周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因: .
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合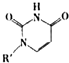 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含 ,b中含 .(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图

中错误:
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含