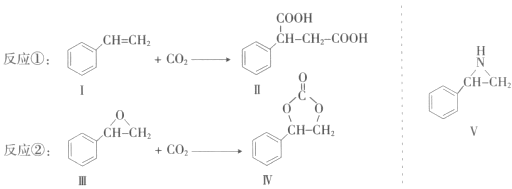
题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,消毒时本身被还原成氯离子,也常用来漂白织物等,其一种生产工艺如下:
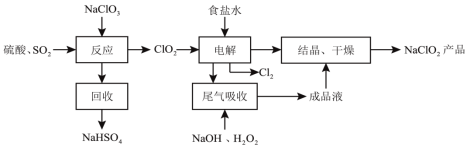
回答下列问题:
(1)NaClO2中Cl的化合价为__________。
(2)写出“反应”步骤中生成ClO2的离子方程式________,该过程体现了SO2的______________( 选填:a 氧化性、b还原性、c漂白性、d酸性氧化物的通性)
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去SO![]() 和Mg2+要加入的试剂分别为__________、__________。“电解”过程的氧化产物是Cl2,则还原产物是_______。
和Mg2+要加入的试剂分别为__________、__________。“电解”过程的氧化产物是Cl2,则还原产物是_______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应的化学方程式为__________,实验室进行结晶操作使用的仪器有铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳和__________。
(5)消毒能力可用单位质量消毒剂得电子多少来衡量。NaClO2与Cl2消毒能力比为___________。(不必化简)。
【答案】+3 2ClO![]() +SO2=2ClO2+SO
+SO2=2ClO2+SO![]() b BaCl2 NaOH NaClO2 2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2 蒸发皿 142:90.5
b BaCl2 NaOH NaClO2 2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2 蒸发皿 142:90.5
【解析】
根据流程,将硫酸、SO2中加入NaClO3,可制得ClO2气体和NaHSO4,可以回收并利用NaHSO4,将ClO2和食盐水一同电解,可制得Cl2和NaClO2,将制得的NaClO2进行结晶、干燥制得NaClO2成品,流程中加入硫酸和SO2的目的是为反应提供还原剂,使Cl转化为ClO2,进行下一步反应,电解过程中加入食盐水,目的是使ClO2转化为所要的NaClO2,食盐中含有较多可溶性杂质,使用时需要加入一定的化学试剂将杂质除去,得到纯净的食盐,据此分析。
(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3;
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO3是氧化剂,还原产物为NaCl,根据得失电子守恒和原子守恒,此反应的离子方程式为2ClO![]() +SO2=2ClO2+SO
+SO2=2ClO2+SO![]() ;在反应中SO2的S元素化合价升高,体现了SO2的还原性;
;在反应中SO2的S元素化合价升高,体现了SO2的还原性;
(3)食盐溶液中混有SO![]() 和Mg2+,可利用过量NaOH溶液除去Mg2+,利用过量BaCl2溶液除去SO
和Mg2+,可利用过量NaOH溶液除去Mg2+,利用过量BaCl2溶液除去SO![]() ;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
(4)根据图示可知:利用含有过氧化氢的NaOH溶液吸收ClO2气体,产物为NaClO2,则此吸收反应中,氧化剂为ClO2,还原产物为NaClO2,还原剂是H2O2,氧化产物是O2,化学反应方程式是:2NaOH+2ClO2+H2O2=2NaClO2+O2+2H2O;实验室进行结晶操作使用的仪器有铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳和蒸发皿;
(5)每克NaClO2的物质的量n(NaClO2)=![]() mol,其获得电子的物质的量是
mol,其获得电子的物质的量是![]() ×4=
×4=![]() mol;每克Cl2的物质的量n(Cl2)=
mol;每克Cl2的物质的量n(Cl2)=![]() mol,其获得电子的物质的量是
mol,其获得电子的物质的量是![]() ×2=
×2=![]() mol;则NaClO2与Cl2消毒能力比为
mol;则NaClO2与Cl2消毒能力比为![]() :
:![]() =142:90.5。
=142:90.5。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】实验室从含碘的废液(除H2O外,含有CCl4、I2、I 等)中回收碘,其实验过程如下,下列各项操作选用的装置不正确的是( )

选项 | A | B | C | D |
操作 | 操作X | 氧化 | 操作Y | 操作Z(加热及夹持装置略去) |
装置 |
|
|
|
|
A. AB. BC. CD. D
【题目】已知常温下KClO3与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间,对图中各部位颜色描述正确的是

选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 橙色 | 白色 | 蓝色 |
B | 无色 | 橙色 | 白色 | 紫色 |
C | 黄绿色 | 橙色 | 无色 | 蓝色 |
D | 黄绿色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D