题目内容
(B类)对于反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若有0.1molKMnO4参加反应,下列说法中正确的是( )
分析:得电子的反应物是氧化剂,失电子的反应物是还原剂,根据元素化合价的变化判断氧化剂和还原剂以及电子转移的数目.
解答:解:A.该反应中高锰酸钾中的锰元素化合价降低,所以高锰酸钾是氧化剂,故A错误;
B.根据反应方程式知,若有0.1molKMnO4 参加反应,应有0.25mol氯气生成,温度和压强未知,所以无法计算其体积,故B错误;
C.由方程式可知,若有0.1molKMnO4 参加反应,应有0.8molHCl参加反应,故C错误;
D.转移电子的物质的量为0.1mol×(7-2)=0.5mol,故D正确;
故选D.
B.根据反应方程式知,若有0.1molKMnO4 参加反应,应有0.25mol氯气生成,温度和压强未知,所以无法计算其体积,故B错误;
C.由方程式可知,若有0.1molKMnO4 参加反应,应有0.8molHCl参加反应,故C错误;
D.转移电子的物质的量为0.1mol×(7-2)=0.5mol,故D正确;
故选D.
点评:本题考查氧化还原反应,题目难度中等,易错选项是B,有关气体体积的计算一定要注意温度和压强,没有标明温度和压强,气体摩尔体积不能 用22.4L/mol,为易错点.

练习册系列答案
相关题目
下列叙述与图象对应符合的是( )
A、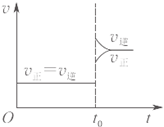 对于达到平衡状态的N2(g)+3H2(g)?2NH3(g),如图表示在t0时刻充入了一定的NH3,平衡逆向移动 | B、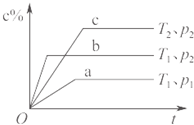 由如图可知p2>p1,T1>T2 | C、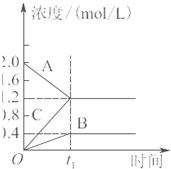 如图表示的方程式为2A?B+3C | D、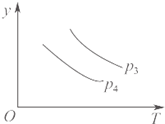 对于反应2X(g)+3Y(g)?2Z(g)△H<0,如图y轴可以表示Y的百分含量 |
 根据如图判断下列说法正确的是( )
根据如图判断下列说法正确的是( )