题目内容
20.将pH=8的Ba(OH)2 溶液稀释1000倍,则稀释后的溶液中c(Ba2+)与c(OH-)之比为( )| A. | 1:2 | B. | 1:200 | C. | 1:50 | D. | 1:100 |
分析 由氢氧化钡溶液pH=8,计算原溶液中c(OH-),原溶液中c(Ba2+)=$\frac{1}{2}$c(OH-),稀释1000倍,此时溶液接近中性,氢氧根离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中钡离子的物质的量不变,计算稀释后溶液中钡离子的物质的量浓度,据此计算解答.
解答 解:pH为8的氢氧化钡溶液中氢氧根离子浓度为:c(OH-)=1×10-6mol/L,钡离子的浓度为:c(Ba2+)=$\frac{1}{2}$c(OH-)=$\frac{1}{2}$×1×10-6mol/L=5×10-7mol/L;
溶液稀释1000倍后,氢氧根离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而钡离子浓度为:c(Ba2+)=5×10-7mol/L×$\frac{1}{1000}$=5×10-10mol/L,
所以稀释后溶液中钡离子浓度与氢氧根离子浓度的比值约为:5×10-10mol/L:1×10-7mol/L=1:200,
故选B.
点评 本题考查了溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,确定溶液中氢离子的近似浓度是关键,注意酸碱稀释接近中性应考虑水的电离.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.如图关于碳循环的说法不正确的是( )


| A. | 氧元素也参与了碳循环 | B. | 绿色植物可吸收大气中CO2 | ||
| C. | 大量燃烧化石燃料会造成温室效应 | D. | 呼吸和光合作用时碳元素均被氧化 |
11.室温下,将碳酸钠溶液加热至70℃,其结果是( )
| A. | 溶液中c(CO32-)增大 | B. | 水的电离程序不变 | ||
| C. | KW(水的离子积)将变小 | D. | 溶液的碱性增强 |
16.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为283kJ/mol、285.8kJ/mol、768kJ/mol工业上一般采用利用合成气发生下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.
①完成该热化学方程式:CO(g)+2H2(g)?CH3OH(g)△H-127.4KJ kJ/mol;
②某温度下,将2mol CO和6mol H2充人2L的密闭容器中,充分反应达到平衡,
测得c( H2)=2.2mol•L-1,则CO的转化率为40%.
(2)T1℃时,此反应的平衡常数为K(T1)=50.此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正=v逆值(填“>”、“<”或“=”).
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)=0.3mol,试比较:温度T1<T2(填“>”、“=”或“<”,下同)T2℃时该反应的平衡常数K(T2)<50.
③若其他条件不变时,只改变反应的某一个条件,下列说法正确的是BC.
A.若达到新平衡时c(CO)=0.3mo1/L,平衡一定逆向移动
B.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
C.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
D.若向容器中加入0.8mol CH3 OH(g),达到新平衡时,CO的体积分数不变.
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为283kJ/mol、285.8kJ/mol、768kJ/mol工业上一般采用利用合成气发生下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.
①完成该热化学方程式:CO(g)+2H2(g)?CH3OH(g)△H-127.4KJ kJ/mol;
②某温度下,将2mol CO和6mol H2充人2L的密闭容器中,充分反应达到平衡,
测得c( H2)=2.2mol•L-1,则CO的转化率为40%.
(2)T1℃时,此反应的平衡常数为K(T1)=50.此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | C H3O H |
| 浓度/(mol•L-1) | 0.2 | 0.2 | 0.4 |
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)=0.3mol,试比较:温度T1<T2(填“>”、“=”或“<”,下同)T2℃时该反应的平衡常数K(T2)<50.
③若其他条件不变时,只改变反应的某一个条件,下列说法正确的是BC.
A.若达到新平衡时c(CO)=0.3mo1/L,平衡一定逆向移动
B.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
C.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
D.若向容器中加入0.8mol CH3 OH(g),达到新平衡时,CO的体积分数不变.
17.下列离子方程式中,错误的是( )
| A. | 碳酸钠溶液跟足量稀H2SO4混合:CO32-+2H+═H2O+CO2↑ | |
| B. | 硝酸铜溶液中滴加烧碱溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 次氯酸溶液中加入氢氧化钾溶液:H++OH-═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
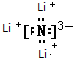 .写出该物质与水反应的化学方程式:Li3N+3 H2O=3 LiOH+NH3↑.
.写出该物质与水反应的化学方程式:Li3N+3 H2O=3 LiOH+NH3↑.