题目内容
15.一些主族元素的化学性质和它在元素周期表中的左上方或右下方的另一主族元素的性质相似,这称为对角线规则.如Li与Mg、Be与Al为对角线关系,它们的化学性质相似.已知镁在空气中燃烧时,生成氧化镁和氮化镁.氮化锂易与水发生反应.请回答下列问题:(1)锂在空气中燃烧时,生成的产物成分除Li2O(填化学式)外,还有微量的另一种物质,该物质的电子式为
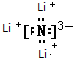 .写出该物质与水反应的化学方程式:Li3N+3 H2O=3 LiOH+NH3↑.
.写出该物质与水反应的化学方程式:Li3N+3 H2O=3 LiOH+NH3↑.(2)写出能证明铍的最高价氧化物对应的水化物是两性氢氧化物的有关反应的离子方程式:Be(OH)2+2H+=Be2++2H2O、Be(OH)2+2OH-=BeO22-+2H2O.
(3)BeCl2溶液和MgCl2溶液可用氢氧化钠溶液试剂加以鉴别,其操作和现象是取两种待测液少许分别放入试管中,分别向试管中持续加入氢氧化钠溶液到过量,先产生沉淀,后沉淀溶解的是氯化铍,产生沉淀沉淀不溶解的是氯化镁.
分析 (1)依据题意一些主族元素的化学性质和它在元素周期表中的左上方或右下方的另一主族元素的性质相似,这称为对角线规则.如Li与Mg、Be与Al为对角线关系,它们的化学性质相似,镁在空气中燃烧时,生成氧化镁和氮化镁,可知锂在空气中燃烧生成氧化锂和少量氮化锂,氮化锂是离子化合物,氮离子和锂离子之间存在离子键;依据氮化镁与水反应原理书写氮化锂与水反应方程式;
(2)两性氢氧化物既能与酸反应生成盐和水,也能与碱反应生成盐和水,依据氢氧化铝与盐酸、氢氧化钠反应的离子方程式书写;
(3)依据氯化铍与氢氧化钠反应先生成氢氧化铍沉淀,氢氧化铍沉淀再与氢氧化钠反应生成偏铍酸钠和水,氯化镁与氢氧化钠反应生成氢氧化镁沉淀解答.
解答 解:(1)由题意可知:Li与Mg处于对角线关系,二者性质相似,镁在空气中可以与氧气、氮气反应生成氧化镁、氮化镁,推知锂在空气中与氧气反应生成氧化锂和氮化锂化学式分别为:Li2O、Li3N;氮化锂是离子化合物,氮离子和锂离子之间存在离子键,所以氮化锂的电子式为: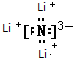 ;
;
氮化镁与水反应生成氢氧化镁和氨气,所以氮化锂与水反应生成氢氧化锂和氨气,化学方程式:Li3N+3 H2O=3 LiOH+NH3↑;
故答案为:Li2O;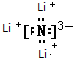 ;Li3N+3 H2O=3 LiOH+NH3↑;
;Li3N+3 H2O=3 LiOH+NH3↑;
(2)氢氧化铝与盐酸反应生成氯化铝和水,所以氢氧化铍与盐酸反应生成氯化铍和水,离子方程式:Be(OH)2+2H+=Be2++2H2O;
氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,所以氢氧化铍与盐酸反应生成偏铍酸钠和水,离子方程式:Be(OH)2+2OH-=BeO22-+2H2O;
故答案为:Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO22-+2H2O;
(3)氯化铍与氢氧化钠反应先生成氢氧化铍沉淀,氢氧化铍沉淀再与氢氧化钠反应生成偏铍酸钠和水,氯化镁与氢氧化钠反应生成氢氧化镁沉淀,所以取两种待测液少许分别放入试管中,分别向试管中持续加入氢氧化钠溶液到过量,先产生沉淀,后沉淀溶解的是氯化铍,产生沉淀沉淀不溶解的是氯化镁;
故答案为:氢氧化钠溶液;取两种待测液少许分别放入试管中,分别向试管中持续加入氢氧化钠溶液到过量,先产生沉淀,后沉淀溶解的是氯化铍,产生沉淀沉淀不溶解的是氯化镁;
点评 本题为信息题,考查了元素周期表的对角线规则,准确把握题干中所给信息,明确对角线规则、已经铝、镁的性质推测铍、锂的性质是解题关键,注意两性氢氧化物的性质,题目难度不大.

| A. | 常温常压下,48g O3含有的氧原子数为3NA? | |
| B. | 1.8g的NH${\;}_{4}^{+}$中含有的电子数为0.1NA | |
| C. | 常温常压下,8 g氧气所含的原子数为NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
| A. | CO${\;}_{3}^{2}$- | B. | Al3+ | C. | AlO2- | D. | HCO3- |
| A. | 1:2 | B. | 1:200 | C. | 1:50 | D. | 1:100 |
| A. | H+、Ca2+、Cl-、CO32- | B. | Ba2+、H+、SO42-、CO32- | ||
| C. | K+、Na+、OH-、Cl- | D. | Cu2+、Mg2+、Cl-、SO42- |
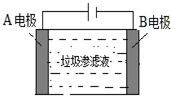 垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到
垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到