题目内容
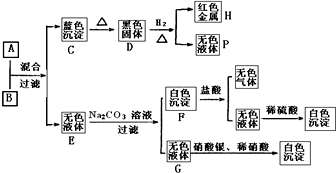
将碱溶液A、盐溶液B按如下程度进行实验,根据下述现象判断:

(1)A和B的化学式
(2)完成下列转化的化学方程式,是离子反应的写出离子方程式.
①D→H+P:
②E→F+G:

(1)A和B的化学式
Ba(OH)2、CuCl2
Ba(OH)2、CuCl2
.(2)完成下列转化的化学方程式,是离子反应的写出离子方程式.
①D→H+P:
H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
| ||
②E→F+G:
Ba2++CO32-=BaCO3↓
Ba2++CO32-=BaCO3↓
.分析:由转化关系图,H为红色金属,H为Cu,C为蓝色沉淀,为Cu(OH)2,加热氢氧化铜时,氢氧化铜分解生成黑色的氧化铜,故D为CuO,氧化铜被氢气还原生成铜和水,所以P为H2O;
碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,B为铜盐,由无色溶液E和碳酸钠溶液反应生成白色沉淀,故G为氯化钠,无色溶液E含有Cl-,故盐溶液B为CuCl2;
F和盐酸反应生成无色气体和无色溶液,白色沉淀F为碳酸盐,该无色溶液和稀硫酸反应生成白色沉淀,故无色溶液含有Ba2+,故白色沉淀为BaCO3,无色溶液E含有Cl-,故E为BaCl2,再结合碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,故A为Ba(OH)2,验证符合转化关系.
碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,B为铜盐,由无色溶液E和碳酸钠溶液反应生成白色沉淀,故G为氯化钠,无色溶液E含有Cl-,故盐溶液B为CuCl2;
F和盐酸反应生成无色气体和无色溶液,白色沉淀F为碳酸盐,该无色溶液和稀硫酸反应生成白色沉淀,故无色溶液含有Ba2+,故白色沉淀为BaCO3,无色溶液E含有Cl-,故E为BaCl2,再结合碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,故A为Ba(OH)2,验证符合转化关系.
解答:解:由转化关系图,H为红色金属,H为Cu,C为蓝色沉淀,为Cu(OH)2,加热氢氧化铜时,氢氧化铜分解生成黑色的氧化铜,故D为CuO,氧化铜被氢气还原生成铜和水,所以P为H2O;
碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,B为铜盐,由无色溶液E和碳酸钠溶液反应生成白色沉淀,故G为氯化钠,无色溶液E含有Cl-,故盐溶液B为CuCl2;
F和盐酸反应生成无色气体和无色溶液,白色沉淀F为碳酸盐,该无色溶液和稀硫酸反应生成白色沉淀,故无色溶液含有Ba2+,故白色沉淀为BaCO3,无色溶液E含有Cl-,故E为BaCl2,再结合碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,故A为Ba(OH)2,
(1)通过以上分析知,A和B分别是Ba(OH)2、CuCl2,
故答案为:Ba(OH)2、CuCl2;
(2)氢气和氧化铜发生氧化还原反应生成铜和水,反应方程式为:H2+CuO
Cu+H2O,
钡离子和碳酸根离子反应生成碳酸钡白色沉淀,离子反应方程式为:Ba2++CO32-=BaCO3↓,
故答案为:H2+CuO
Cu+H2O;Ba2++CO32-=BaCO3↓.
碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,B为铜盐,由无色溶液E和碳酸钠溶液反应生成白色沉淀,故G为氯化钠,无色溶液E含有Cl-,故盐溶液B为CuCl2;
F和盐酸反应生成无色气体和无色溶液,白色沉淀F为碳酸盐,该无色溶液和稀硫酸反应生成白色沉淀,故无色溶液含有Ba2+,故白色沉淀为BaCO3,无色溶液E含有Cl-,故E为BaCl2,再结合碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,故A为Ba(OH)2,
(1)通过以上分析知,A和B分别是Ba(OH)2、CuCl2,
故答案为:Ba(OH)2、CuCl2;
(2)氢气和氧化铜发生氧化还原反应生成铜和水,反应方程式为:H2+CuO
| ||
钡离子和碳酸根离子反应生成碳酸钡白色沉淀,离子反应方程式为:Ba2++CO32-=BaCO3↓,
故答案为:H2+CuO
| ||
点评:本题考查了无机物的推断,利用物质的某些特殊性质来分析解答,以H为突破口采用正逆相结合的方法进行推断,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 将碱溶液A、盐溶液B按如下程度进行实验,根据下述现象判断:
将碱溶液A、盐溶液B按如下程度进行实验,根据下述现象判断:

