题目内容
(2009?海南)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
分析:A.根据转化率=
×100%计算;
B.根据反应速率之比等于化学计量数之比判断化学方程式并计算平衡常数;
C.增大压强,化学平衡常数不变;
D.平衡常数只受温度的影响.
| 转化量 |
| 初始量 |
B.根据反应速率之比等于化学计量数之比判断化学方程式并计算平衡常数;
C.增大压强,化学平衡常数不变;
D.平衡常数只受温度的影响.
解答:解:A.反应达到平衡时,X的转化率为:
×100%=50%,故A正确;
B.根据反应速率之比等于浓度变化量之比等于化学计量数之比可知:△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,
则反应的方程式为X+3Y 2Z,K=
2Z,K=
=
=1600(mol/L)-2,故B正确;
C.增大压强平衡向生成Z的方向移动,但平衡常数不变,故C错误;
D.平衡常数只受温度的影响,温度改变时,化学平衡常数一定变化,故D正确.
故选C.
| 0.1mol/L-0.05mol/L |
| 0.1mol/L |
B.根据反应速率之比等于浓度变化量之比等于化学计量数之比可知:△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,
则反应的方程式为X+3Y
 2Z,K=
2Z,K=| c2(Z) |
| c(X)?c3(Y) |
| (0.1mol/L)2 |
| (0.05mol/L)×(0.05mol/L)3 |
C.增大压强平衡向生成Z的方向移动,但平衡常数不变,故C错误;
D.平衡常数只受温度的影响,温度改变时,化学平衡常数一定变化,故D正确.
故选C.
点评:本题考查化学平衡的计算及平衡移动问题,题目难度不大,注意平衡常数的计算以及平衡常数为温度的函数的特征来解答.

练习册系列答案
相关题目
 (2009?海南)在5mL 0.05mol/L的某金属氯化物溶液中,滴加0.1mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( )
(2009?海南)在5mL 0.05mol/L的某金属氯化物溶液中,滴加0.1mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( )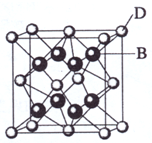 (2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.
(2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.