题目内容
【题目】
氮元素是自然界最丰富的元素,在化学中有很重要的地位。回答下列问题:
(1)基态氮原子的价层电子轨道表达式为_______________________。第二周期的元素中,第一电离能比氮元素的第一电离能小的元素共有__________种。
(2)预计于2017年发射的“嫦饿五号”探测器采用的长征五号运载火箭燃料为偏二甲肼[(CH3)2NNH2]。
(CIUXNH:中N’原子的杂化方式为__________。
(3)利用价层电子互斥理论解释NH3的立体构型为三角锥形的原因:__________________________。与NH3互为等电子体的离子为__________(填化学式,举一例即可)。
(4)在CuSO4溶液中加过量氨水后,再向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O,若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是对其进行_______________________实验。lmol [Cu(NH3)4]2-含有的σ键的数目为__________。
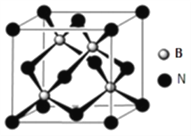
(5)氮化硼可用于制造飞机轴承,其晶胞如图所示,则处于晶胞顶点上的原子的配位数为__________。若立方氮化硼的密度为ρ g/cm3,氮化硼的摩尔质量为M,阿伏伽德罗常数为NA。如果硼原子的半径为r pm,则硼原子的空间利用率为__________。(用含有ρ、M、NA、r的式子表示)
【答案】 ![]() 5 sp3 NH3 中 N 原子成 3 个σ键,有一对孤对电子,价层电子对数为4,形成四面体的VSEPR模型,略去VSEPR模型中心原子上的孤电子对,氨气分子空间构型就是三角锥形 H3O+和 CH3- 等 X 射线衍射 16NA(或 9.632×1024) 4
5 sp3 NH3 中 N 原子成 3 个σ键,有一对孤对电子,价层电子对数为4,形成四面体的VSEPR模型,略去VSEPR模型中心原子上的孤电子对,氨气分子空间构型就是三角锥形 H3O+和 CH3- 等 X 射线衍射 16NA(或 9.632×1024) 4 ![]() ×100%
×100%
【解析】(1)基态氮原子的价层电子轨道表达式为![]() ;第二周期的元素中,第一电离能比氮元素的第一电离能小的元素共有Li、Be、B、C、O共5种;(2)[(CH3)2NNH2]中N’原子的杂化方式为 sp3 杂化;(3)利用价层电子互斥理论解释NH3的立体构型为三角锥形的原因:NH3 中 N 原子成 3 个σ键,有一对孤对电子,价层电子对数为4,形成四面体的VSEPR模型,略去VSEPR模型中心原子上的孤电子对,氨气分子空间构型就是三角锥形 ;可将中心原子N的核电荷放大和缩小的方法获得,与NH3互为等电子体的离子为H3O+和 CH3- 等;(4)确定物质是晶体还是非晶体,最科学的方法是对其进行X 射线衍射;lmol [Cu(NH3)4]2-含有的σ键的数目为:N―H是12mol,Cu―N键4mol,共16mol,或 9.632×1024。(5) 观察面心的N,每个N连有4个B原子,处于晶胞顶点上的原子的配位数为4;晶体中N位于晶胞体对角线的1/4处,将体心与下底面相对的两顶点相连可构成等腰三角形,距离最近的两个N原子相连有连线为三角形的中位线,所以晶体中最近的两个N原子的距离为底面对角线的一半,晶胞中N原子个数为
;第二周期的元素中,第一电离能比氮元素的第一电离能小的元素共有Li、Be、B、C、O共5种;(2)[(CH3)2NNH2]中N’原子的杂化方式为 sp3 杂化;(3)利用价层电子互斥理论解释NH3的立体构型为三角锥形的原因:NH3 中 N 原子成 3 个σ键,有一对孤对电子,价层电子对数为4,形成四面体的VSEPR模型,略去VSEPR模型中心原子上的孤电子对,氨气分子空间构型就是三角锥形 ;可将中心原子N的核电荷放大和缩小的方法获得,与NH3互为等电子体的离子为H3O+和 CH3- 等;(4)确定物质是晶体还是非晶体,最科学的方法是对其进行X 射线衍射;lmol [Cu(NH3)4]2-含有的σ键的数目为:N―H是12mol,Cu―N键4mol,共16mol,或 9.632×1024。(5) 观察面心的N,每个N连有4个B原子,处于晶胞顶点上的原子的配位数为4;晶体中N位于晶胞体对角线的1/4处,将体心与下底面相对的两顶点相连可构成等腰三角形,距离最近的两个N原子相连有连线为三角形的中位线,所以晶体中最近的两个N原子的距离为底面对角线的一半,晶胞中N原子个数为![]() ,B原子个数为4,4个B原子的体积为:
,B原子个数为4,4个B原子的体积为:![]() ,晶胞体积
,晶胞体积![]() ,B的空间利用率为
,B的空间利用率为![]() ×100%=
×100%=![]() ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案


