题目内容
【题目】实验室采用MgCl2、AlCl3混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:

(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应容器中加入________(填“A”、或“B”),再滴加另一反应物。
(2)实验室利用氯化铵和熟石灰反应制取氨气,写出反应的化学方程式________________________。
(3)判断流程中沉淀是否洗净所用的试剂是______________;高温焙烧时,用于盛放固体的仪器名称是__________________。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
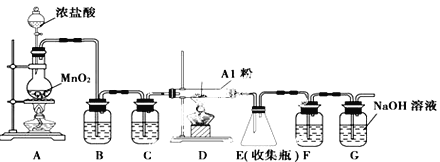
①写出装置A 中发生反应的离子方程式________________________。
②装置B中盛放饱和NaCl溶液,该装置的主要作用是__________;F中试剂的作用是__________;
用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________。
③实验步骤:如图连接装置后,先__________(填实验操作),再装药品,然后点燃______(填“ A” 或“C” )处酒精灯,当________(填实验现象)时,再点燃另一处酒精灯。
④写出装置G 中发生反应的离子方程式________________________。
【答案】 B 2NH4Cl+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O 硝酸酸化的硝酸银(或稀硝酸 硝酸银) 坩埚 MnO2 +4H++2Cl-
2NH3↑+CaCl2+2H2O 硝酸酸化的硝酸银(或稀硝酸 硝酸银) 坩埚 MnO2 +4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中混有的HCl气体 吸收水蒸气 碱石灰 检查装置的气密性 A C中充满黄绿色气体 Cl2 +2OH-=Cl- +ClO- +H2O
Mn2++Cl2↑+2H2O 除去氯气中混有的HCl气体 吸收水蒸气 碱石灰 检查装置的气密性 A C中充满黄绿色气体 Cl2 +2OH-=Cl- +ClO- +H2O
【解析】(1)如先加入MgCl2、AlCl3的混合溶液,再加氨水,氨水少量,应先生成氢氧化铝沉淀,反之,先加氨水,因氨水足量,则同时生成沉淀,所以为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应容器中加入氨水,答案选B;(2)实验室利用氯化铵和熟石灰反应制取氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O。(3)沉淀表面含有氯离子,则判断流程中沉淀是否洗净所用的试剂是硝酸酸化的硝酸银;高温焙烧固体时,用于盛放固体的仪器名称是坩埚。(4)①装置A制备氯气,其中发生反应的离子方程式为MnO2+4H++2Cl-
2NH3↑+CaCl2+2H2O。(3)沉淀表面含有氯离子,则判断流程中沉淀是否洗净所用的试剂是硝酸酸化的硝酸银;高温焙烧固体时,用于盛放固体的仪器名称是坩埚。(4)①装置A制备氯气,其中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。②B中的饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,所以F装置中试剂的作用是吸收水蒸气;G是吸收反应剩余的氯气,所以可以加入碱石灰来代替F和G的作用。③连接好装置后,先检查装置的气密性,再装药品。由于装置中含有空气,加热时能与铝反应,所以首先点燃A处酒精灯,利用氯气排尽装置中的空气,即当C中充满黄绿色气体时,再点燃另一处酒精灯。④装置G吸收多余的氯气,其中发生反应的离子方程式为Cl2 +2OH-=Cl-+ClO-+H2O。
Mn2++Cl2↑+2H2O。②B中的饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,所以F装置中试剂的作用是吸收水蒸气;G是吸收反应剩余的氯气,所以可以加入碱石灰来代替F和G的作用。③连接好装置后,先检查装置的气密性,再装药品。由于装置中含有空气,加热时能与铝反应,所以首先点燃A处酒精灯,利用氯气排尽装置中的空气,即当C中充满黄绿色气体时,再点燃另一处酒精灯。④装置G吸收多余的氯气,其中发生反应的离子方程式为Cl2 +2OH-=Cl-+ClO-+H2O。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为; 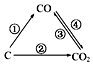
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正v逆(填“>”“<”或“=”).
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F﹣F | N﹣F |
键能/kJmol﹣1 | 941.7 | 154.8 | 283.0 |
则反应N2(g)+3F2(g)═2NF3(g)的△H=
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2
D.△H3=△H1﹣△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=﹣235.8kJmol﹣1 ,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJmol﹣1 ,
则O3转化为O2的热化学方程式为 .