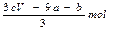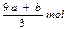题目内容
平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。试通过计算推测该碱式盐的化学式。
n(CO32-)=0.005mol(2分),n(OH-)=0.08mol(2分),
n[Mg(OH)2]=1.74g58g/mol=0.03mol(2分),n(Al3+)=0.01mol(2分),
碱式盐中含有结晶水(1分),碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O(1分)。
n[Mg(OH)2]=1.74g58g/mol=0.03mol(2分),n(Al3+)=0.01mol(2分),
碱式盐中含有结晶水(1分),碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O(1分)。
当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,可得n(CO2)=n(CO32-)=2.5×10-3×2=0.005mol,而中和OH-需要盐酸42.5-2.5=40mL,所以n(OH-)=40×10-3×2=0.08mol。加入过量的氢氧化钠得沉淀Mg(OH)21.74g,n(Mg2+)=1.74/58=0.03mol,根据电荷守恒,n(Al3+)=(0.08+0.005×2-0.03×2)/3=0.01mol。依据质量守恒,物质中含有结晶水3.01-0.005×60-0.08×17-0.03×24-0.01×27=0.36g, 0.02mol,综合以上,该碱式碳酸盐的化学式为Al2Mg6(OH)16CO3·4H2O。

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
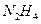 )作为燃料,
)作为燃料,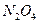 作为推进剂。
作为推进剂。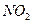 ,对环境会造
,对环境会造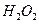
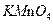
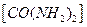 和次氯酸钠反应可以制取联氨(产物中
和次氯酸钠反应可以制取联氨(产物中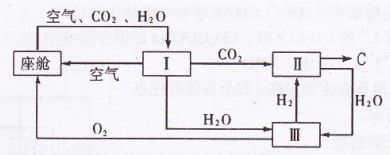
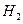 、
、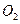 和 ;装置Ⅱ中
和 ;装置Ⅱ中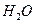 ,则呼出的气体中含
,则呼出的气体中含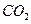 mol.
mol.