题目内容
17.分类是重要的科学研究方法,下列物质分类错误的是( )| A. | 电解质:明矾、碳酸、硫酸钡 | B. | 酸性氧化物:SO3、CO2、NO | ||
| C. | 混合物:铝热剂、矿泉水、焦炉气 | D. | 同素异形体:C60、C70、金刚石 |
分析 A.电解质:在水溶液中或熔融状态下能够导电的化合物;
B.酸性氧化物:能与水作用生成相应价态的酸,或与碱作用生成盐和水,或与碱性氧化物反应生成盐的氧化物;
C.混合物:由两种或多种物质混合而成的物质;
D.相同元素组成,不同形态的单质互为同素异形体.
解答 解:A.明矾、碳酸、硫酸钡在水溶液中都能够导电,属于电解质,故A正确;
B.CO2、SO3属于酸性氧化物:NO为不成盐氧化物,故B错误;
C.铝热剂是铝粉和三氧化二铁粉末的混合物、矿泉水是水与盐类的混合物、焦炉气是CO和氢气的混合气体,故C正确;
D.C60、C70、金刚石是由碳元素形成的不同单质,互为同素异形体,故D正确;
故选B.
点评 本题考查电解质、酸性氧化物、混合物、同素异形体的概念,难度不大.要注意基础知识的积累.

练习册系列答案
相关题目
7.已知:①C(S)+O2=CO2(g)△H1=-394kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)
④2C(s)+H2(g)=C2H2(g)△H4
下列正确的是( )
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)
④2C(s)+H2(g)=C2H2(g)△H4
下列正确的是( )
| A. | 反应①放出197kJ的热量,转移4mol电子 | |
| B. | 反应②可知1mol液态水分解所放出的热量为242kJ | |
| C. | 反应③表示C2H2燃烧热的热化学方程式 | |
| D. | △H4=2△H1+△H2-$\frac{1}{2}$△H3 |
8.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 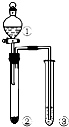 |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2(足量) | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硝酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
5.聚乳酸是一种生物降解塑料,结构简式为  .下列说法正确的是( )
.下列说法正确的是( )
 .下列说法正确的是( )
.下列说法正确的是( )| A. | 聚乳酸的相对分子质量是72 | B. | 聚乳酸的分子式是C3H4O2 | ||
| C. | 乳酸的分子式是C3H6O2 | D. | 聚乳酸可以通过水解降解 |
12.在pH=1的酸溶液和pH=13的氢氧化钠溶液中,分别加入过量的铝粉,若酸溶液放出的氢气多,其可能的原因是( )
| A. | 两溶液体积相同,酸是多元强酸 | |
| B. | 两溶液体积相同,酸是弱酸 | |
| C. | 酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上 | |
| D. | 酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上 |
2.如图是部分短周期元素原子半径与原子序数的关系图.字母代表元素,分析正确的是( )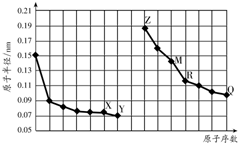

| A. | R在周期表的第15列 | |
| B. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
6.有机物M的结构简式如图所示,下列说法正确的是( )


| A. | 分子式为C17H18O3 | |
| B. | M中有4个饱和碳原子 | |
| C. | M可以使溴水和酸性高锰酸钾溶液褪色,但它们的反应类型不同 | |
| D. | 1mol M常温下最多可以与6 mol H2反应 |
7.下列分离方法中,和物质的溶解度无关的是( )
| A. | 萃取 | B. | 纸上层析 | C. | 过滤 | D. | 蒸馏 |
 HClO+H++Cl-、HClO
HClO+H++Cl-、HClO H++ClO-、Cl2(g)
H++ClO-、Cl2(g) Cl2(aq).
Cl2(aq).