题目内容
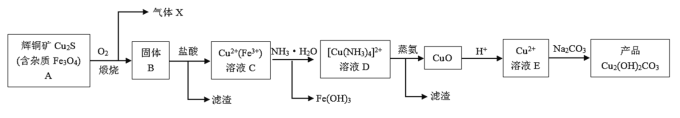
【题目】某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:
已知:Cu(OH)2溶于氨水形成[Cu(NH3)4]2+
根据以上工艺流程,下列说法不正确的是( )
A.为实现溶液C到溶液D的转化,加入过量的NH3H2O后过滤即可
B.溶液E和碳酸钠混合方式不同对产品的成分没有影响
C.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因可能是游离的Cu2+浓度太低
D.蒸氨过程发生总反应的化学方程式为:
【答案】B
【解析】
辉铜矿在空气中煅烧后得到铜的氧化物和铁的氧化物,加盐酸溶解,得到含Cu2+和Fe3+的溶液,加入过量的氨水,Cu2+和过量的氨水形成[Cu(NH3)4]2+,Fe3+和氨水生成Fe(OH)3沉淀,过量后得到的溶液D中主要含有[Cu(NH3)4]2+和Cl-,蒸氨后得到氧化铜,加酸后生成Cu2+,再和碳酸钠反应得到碱式碳酸铜。
A.为实现溶液C到溶液D的转化,加入过量的NH3H2O,Cu2+和过量的氨水形成[Cu(NH3)4]2+,Fe3+和氨水生成Fe(OH)3沉淀,过滤即可,故A正确;
B.溶液E中含Cu2+,和碳酸钠溶液混合制取碱式碳酸铜,若将含Cu2+的溶液加入到碳酸钠溶液中,由于碳酸钠溶液是碱性的,可生成大量的氢氧化铜而不能得到纯净的碱式碳酸铜,所以混合方式不同对产品的成分有影响。制取碱式碳酸铜通常用碳酸钠溶液和硝酸铜溶液,控制两者的比例和反应温度以及溶液的pH,最后可得到比较纯的碱式碳酸铜,故B错误;
C.在制备产品时,溶液D中主要含的离子是[Cu(NH3)4]2+,游离的Cu2+浓度太低,直接加入Na2CO3溶液,不能得到较多的产品,故C正确;
D.溶液D中主要含有[Cu(NH3)4]2+和Cl-,蒸氨后得到氧化铜,所以蒸氨过程发生总反应的化学方程式为: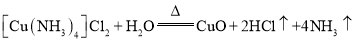 ,故D正确;
,故D正确;
故选B。

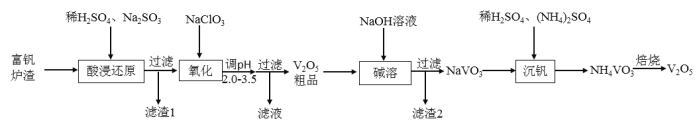
【题目】![]() 是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有
是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有![]() 、
、![]() 和少量
和少量![]() 、
、![]() )中提取,其工艺流程如下:
)中提取,其工艺流程如下:
已知:①![]()
②一些金属阳离子沉淀的pH范围:
开始沉淀pH | 完全沉淀pH | |
| 6.5 | 9.0 |
| 2.2 | 3.5 |
| 4.1 | 5.4 |
(1)“酸浸还原”时![]() 转化为
转化为![]() ,写出有关
,写出有关![]() 反应的离子方程式________;经“氧化”后钒以
反应的离子方程式________;经“氧化”后钒以![]() 存在,写出生成
存在,写出生成![]() 反应的离子方程式________。
反应的离子方程式________。
(2)调节溶液![]() 至2.0~3.5,宜选用的试剂是________(填标号)。/span>
至2.0~3.5,宜选用的试剂是________(填标号)。/span>
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)“滤渣1”的主要成分是________;![]() 粗品中的杂质为________。
粗品中的杂质为________。
(4)“沉钒”时需加入稀![]() ,其目的是________。
,其目的是________。
(5)焙烧产生的气体用________吸收后,其产物可以在该工艺中循环利用。
(6)![]() 在一定条件下可转化为不同价态的钒离子(
在一定条件下可转化为不同价态的钒离子(![]() 、
、![]() 、
、![]() 、
、![]() ),可作为全钒液充电流电池的电极液,电池总反应为
),可作为全钒液充电流电池的电极液,电池总反应为![]() 。下图是钒电池基本工作原理示意图:
。下图是钒电池基本工作原理示意图:
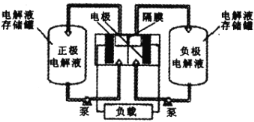
充电时阳极的反应式为____;能够通过钒电池基本工作原理示意图中“隔膜”的离子是_____。