题目内容
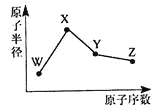
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
【答案】D
【解析】试题分析:W的质子数=质量数-中子数=18-10=8,推出W:O,四种元素为短周期元素,X和Ne原子的核外电子数相差1,X可能为F或Na,Y的单质是一种常见的半导体材料,推出Y:Si,Z的非金属在同周期元素中最强的,Z可能是F或Cl,根据原子序数和原子半径的关系,得出X:Na,Z:Cl,A、WX的简单离子,核外电子排布相同,离子半径随原子序数的递增而减小,所以O2->Na+,故A说法正确;B、氢化物的稳定性与非金属性有关,非金属性越强,其氢化物越稳定,同周期从左向右非金属性增强,故非金属性Cl>Si,说法正确;C、此化合物的化学式NaClO,属于离子键,且含有共价键,故C说法正确;D、Z的氢化物为HCl,X的最高价氧化物对应水化物是NaOH,Y的氧化物是SiO2,二氧化硅不与盐酸反应,故D错误。

【题目】液化石油气作为燃料,已普遍进入城市家庭,它是含有下列物质的混合物,在常压下,这些物质的沸点如下表所示:
物质名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 | 69.2 |
在常温下使用至无气体放出时,钢瓶中常剩余一些液态物质,这些物质最有可能是( )
A. 乙烷、丙烷和丁烷 B. 乙烷和丙烷
C. 只有乙烷 D. 戊烷和己烷