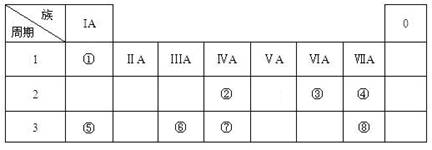
题目内容
(16分)(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)= CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)= 2H2O(1) △H<0
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
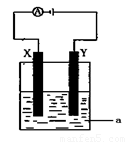
①若a为CuSO4溶液,则电解时的化学反应方程式为 。通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的状态,则电解过程中转移的电子的物质的量为
②若电解含有1molNaCl溶液400ml,当阳极产生的气体448mL(标准状况下)时,溶液的C(OH—) = (假设电解后溶液体积不变)。
(1)C
(2)①2CuSO4+2H2O 2Cu+O2↑+2H2SO4。 0.4mol ②C(H+)=0.1mol.L-1
2Cu+O2↑+2H2SO4。 0.4mol ②C(H+)=0.1mol.L-1
【解析】

(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式: 正极: ;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
该反应的反应方程式可表示为 ,平衡时Y气体的转化率 。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为 ;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量 。