题目内容
(16分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。请回答下列问题(填空时用实际符号):
(1)C的元素符号是 ;元素F在周期表中的位置 。
(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为 ,其固体时的晶体类型是 。
(3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示,已知断裂lmolC-C吸收167kJ热量,生成Imo1C=C放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
①C4属于一种新型的化合物
②C4沸点比P4(白磷)低
③lmol C4气体转变为C2吸收882kJ热量
④C4与C2互为同素异形体
⑤C4稳定性比P4(白磷)差
⑥C4属于原子晶体
⑦C4和P4 (白磷)的晶体都属于分子晶体
⑧C4与C2互为同分异构体
(4)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为 ,其空间构型为 。
(5)为了除去化合物乙(A2ED4);)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:
(6)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是 。
a.E2F2的结构式为:F-E—E- F
b.E2F2为含有极性键 和非极性键的非极性分子
c.E2Br2与E2F2结构相似,熔沸点:E2Br2> E2F2
d.E2F2与H2O反应的化学方程式可能为:2 E2F2+2H2O=EO2↑+ 3E↓+4HF
(7)举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):
(1)N 第3周期第ⅦA族 (1,分)
(2)![]() (2分) 分子晶体 (1分)
(2分) 分子晶体 (1分)
(3)②④⑦ (3吩。选对l个得l分,有错选的0分)
(4)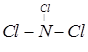 (1分) 三角锥形 (1分)
(1分) 三角锥形 (1分)
(5)H2O2+H2SO3=2H+十S![]() +H2O (2分)
+H2O (2分)
(6)acd (3分。选对1个得1分,有错选得0分) (7)C12+H2S=S+2HCI(2分)
解析:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(16分) 现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19。在它们的化合物中,主要化合价均不止一种,但都有一种相同的化合价,C的单质常用于太阳能电池。它们的一些物理量如下:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 单质的沸点/℃ | 444.6 | 4827 | 2355 | –195.8 |
(1)A的元素符号为__________,D元素在周期表第_______周期、第_______族。
(2)在常温下,B与C的最高价氧化物分别为气态和固态,原因是____________________。
(3)含D的两种常见化合物发生化合反应可生成一种离子化合物,该离子化合物撞击时可分解为两种非金属单质和一种化合物,其中一种为D单质,写出该分解反应的化学方程式____________________________________________________________________。
(4)A、B、C、D均能分别形成含18个电子的氢化物,这些氢化物的分子式分别是________________________________________________。
(5)B、D及氢元素中的两种或三种可形成多种含14个电子的化合物,其中空间构型为直线型的是_______________________和_______________________(写结构式)。
(16分)现有A、B、C、D、E可溶于水的五种化合物,其组成的离子如下表,且每种离子只有一次。
| 阳离子 | Ag+ Na+ Fe3+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- SO32— NO SO42— |
①C溶液显黄色,其它溶液均为无色溶液。
②已知向B、C、D、E溶液分别加入A溶液均产生白色沉淀;
③B溶液与适量E溶液反应生成白色沉淀,加入过量E溶液,白色沉淀量减少,但不完全消失。
(1)据此推断它们的化学式:
A__________;B__________;C________;D________;E________。
(2)B溶液加入少量E溶液的离子方程式____________________________________。
(3)向C溶液滴加少量的D溶液的离子方程式_________________________________。
(16分)现有A、B、C、D、E可溶于水的五种化合物,其组成的离子如下表,且每种离子只有一次。
| 阳离子 | Ag+ Na+ Fe3+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- SO32— NO SO42— |
①C溶液显黄色,其它溶液均为无色溶液。
②已知向B、C、D、E溶液分别加入A溶液均产生白色沉淀;
③B溶液与适量E溶液反应生成白色沉淀,加入过量E溶液,白色沉淀量减少,但不完全消失。
(1)据此推断它们的化学式:
A__________;B__________;C________;D________;E________。
(2)B溶液加入少量E溶液的离子方程式____________________________________。
(3)向C溶液滴加少量的D溶液的离子方程式_________________________________。