题目内容
【题目】某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、CO32-、Na+、Mg2+,为了确定溶液的组成,取100mL该溶液进行如下实验:
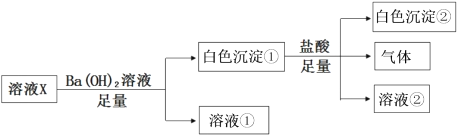
(1)溶液X中一定存在的离子有__________;一定不存在的离子有________。
(2)写出白色沉淀①与足量盐酸反应的离子方程式_____________。
【答案】SO42-、CO32-、Na+ Mg2+ BaCO3 + 2H+ = Ba2+ + H2O + CO2↑
【解析】
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、CO32-、Na+、Mg2+,加入足量氢氧化钡溶液,产生白色沉淀①和溶液①,白色沉淀①中加入足量盐酸,产生气体,则可判断溶液X中含有CO32-,沉淀①中含有BaCO3,因Mg2+与CO32-不能大量共存则溶液X中不含Mg2+,反应后还有白色沉淀②,则为不溶于盐酸的BaSO4,可判断溶液X中含有SO42-;根据溶液为电中性可判断还含有阳离子Na+;不能确定溶液中是否含有Cl-,据此分析。
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、CO32-、Na+、Mg2+,加入足量氢氧化钡溶液,产生白色沉淀①和溶液①,白色沉淀①中加入足量盐酸,产生气体,则可判断溶液X中含有CO32-,沉淀①中含有BaCO3,因Mg2+与CO32-不能大量共存则溶液X中不含Mg2+,反应后还有白色沉淀②,则为不溶于盐酸的BaSO4,可判断溶液X中含有SO42-;根据溶液为电中性可判断还含有阳离子Na+;不能确定溶液中是否含有Cl-。
根据分析可知:(1)溶液X中一定存在的离子有SO42-、CO32-、Na+;一定不存在的离子有Mg2+;
(2)写出白色沉淀①与足量盐酸反应的离子方程式为BaCO3 + 2H+ = Ba2+ + H2O + CO2↑。

【题目】我国工业废水中几种污染物即其最高允许排放浓度如下表。下列说法不正确的是
污染物 | 汞 | 镉 | 铬 | 铅 | 砷 | 氰化物 |
主要存在形式 |
|
|
|
|
|
|
最高允许排放浓度
|
|
|
|
|
|
|
注:我国规定酸、碱废水pH的最大允许排放标准是大于6、小于![]()
A.![]() 、
、![]() 、
、![]() 是重金属离子
是重金属离子
B.对于![]() 的废水可用中和法处理
的废水可用中和法处理
C.将![]() 转化为
转化为![]() 是用氧化还原的方法
是用氧化还原的方法
D.在含有![]() 的废水中加入
的废水中加入![]() ,可使转变为沉淀而除去
,可使转变为沉淀而除去