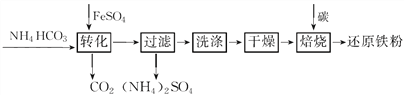
题目内容
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。Fe与N相比,第一电离能较大的是_______________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型为_______________和_______________。
)分子中碳原子轨道的杂化类型为_______________和_______________。
(3)C、N、O三种元素形成的氢化物沸点从高到低的顺序为:_____________,原因是________________。
(4)1molN2分子中含有σ键____________mol,含π键______________mol。
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(xn) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2 所示,其中更稳定的Cu替代型产物的化学式为___________。

【答案】 [Ar]3d5或 1s22s22p63s23p63d5 N sp2 sp3 H2O>NH3>CH4 液态水和液态氨都存在氢键,甲烷没有。O的电负性大于N,水分子中O能形成的氢键数目比液氨中N能形成的氢键数目多。因此H2O>NH3>CH4. 1mol 2mol Fe3CuN
【解析】(1)Fe原子序数为26,Fe3+基态核外电子为23,且3 d电子 为半满稳定结构,可知Fe3+基态核外电子排布式为[Ar]3d5或 1s22s22p63s23p63d5 ,铁的第一电离能是:759.3KJ/mol,N的第一电离能为1400KJ/mol,Fe与N相比,第一电离能较大的是N。
(2)丙酮(![]() )分子中,单键均为σ键,双键中含有1 个σ键,甲基上的C形成4 个σ键,C=O中C形成3 个σ键,均为孤对电子,则羰基上C为sp2杂化,甲基上C为sp3杂化。
)分子中,单键均为σ键,双键中含有1 个σ键,甲基上的C形成4 个σ键,C=O中C形成3 个σ键,均为孤对电子,则羰基上C为sp2杂化,甲基上C为sp3杂化。
(3)C、N、O三种元素氢化物沸点从高到低的顺序为H2O>NH3>CH4,原因是液态水和液态氨都存在氢键,甲烷没有。O的电负性大于N,水分子中O能形成的氢键数目比液氨中N能形成的氢键数目多。因此H2O>NH3>CH4.。
(4)N2分子结构式为N≡N,1molN2分子含有σ键1mol,π键2mol。
(5)由图2 可知,Cu替代a位置的Fe 时能量较低,更稳定,则Cu位于顶点,N(Cu)=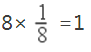 ,Fe位于面心,N(Fe)
,Fe位于面心,N(Fe)![]() ,N位于体心,则只有1 个N,其化学式为:Fe3CuN 。
,N位于体心,则只有1 个N,其化学式为:Fe3CuN 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案