题目内容
10.下列说法正确的是( )| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学变化一定有化学键的断裂和形成 |
分析 A、离子化合物中也可能含有共价键;
B、铵盐中全部为非金属元素,但含有离子键;
C、电子数相同的微粒可能为离子、原子、分子等;
D、化学反应的实质为旧键断裂和新键生成.
解答 解:A、离子化合物中也可能含有共价键,如NaOH等,故A错误;
B、铵盐中全部为非金属元素,但铵根离子与酸根离子之间以离子键结合,故B错误;
C、电子数相同的微粒可能为离子、原子、分子等,如HF、Ne、Na+都为10电子微粒,则不一定为同种元素,故C错误;
D、化学反应的实质为旧键断裂和新键生成,则化学变化中一定有化学键的断裂和形成,故D正确;
故选D.
点评 本题考查化学键,明确化学键的形成及特例是解答本题的关键,学生应学会利用举例的方法来解答,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
5.一定条件下,燃烧1g乙炔(C2H2)气体,生成液态水和二氧化碳,放出50kJ热量,则该条件下乙炔的燃烧热为( )
| A. | 50 kJ/mol | B. | 3900 kJ/mol | C. | 1300 kJ/mol | D. | 450 kJ/mol |
15.恒温恒压下,对于反应X2(g)+Y2(g)?2XY(g)达到平衡状态的标志是( )
| A. | V正(X2)═2V逆(XY) | |
| B. | 单位时间内生成2n mol XY的同时,生n mol的Y2 | |
| C. | 容器内气体密度不随时间而变化 | |
| D. | X2、Y、XY的浓度之比为2:2:1 |
2.体积为1dm3的干燥烧瓶用排空气法冲入氨气后,测得烧瓶中气体对氧气的相对密度为0.625,用此气体进行喷泉实验,当喷泉停止后,进入烧瓶中液体的体积为( )
| A. | $\frac{3}{4}$dm3 | B. | $\frac{1}{2}$dm3 | C. | $\frac{1}{4}$dm3 | D. | 全满 |
19.下列叙述中,正确的是( )
| A. | 物质的量是国际科学界建议采用的一种物理量 | |
| B. | 摩尔质量就等于物质的相对分子质量 | |
| C. | 1gH2和1 mol H2O的物质的量相等 | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
20.下列有关离子检验的叙述正确的是( )
| A. | 向某溶液中加入盐酸化的BaCl 2 溶液,产生白色沉淀,说明溶液中含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中通入CO2气体产生的白色沉淀,说明溶液中含有Ca2+ | |
| C. | 含有大量Cl-、CO${\;}_{4}^{2-}$、OH-的五色溶液中,可以依次加入酚酞、BaCl2、硝酸酸化的AgNO3溶液加以验证 | |
| D. | 向某浅绿色溶液中加入KSCN溶液后溶液不变红,再加入H2O2溶液后溶液变红,说明其中含有Fe2+ |
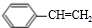 ,D是
,D是 ,E是
,E是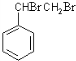 ,G是
,G是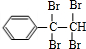 .
.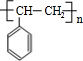 .
. .
.