��Ŀ����
ʵ������ȡ�������������������100ml 1.7mol/L��NaOH��Һ��ȫ���գ������պ����Һ���з������飬��֪��pH����13 �������Ƿ�Ӧǰ����Һ������仯����ClO-��ClO3-�����ʵ���Ũ��֮��Ϊ5��1����ش�
��1�������������ĵ�NaOH�����ʵ���Ϊ
��2�������������������ʵ���Ϊ
��3�������ö������̺�Ũ���Ṳ�ȵķ������������Ʊ���β���е��������������ĵĶ������̵�����Ϊ
��1�������������ĵ�NaOH�����ʵ���Ϊ
0.16
0.16
mol����2�������������������ʵ���Ϊ
0.03
0.03
mol������ԭ�����������ʵ���Ϊ0.05
0.05
mol����3�������ö������̺�Ũ���Ṳ�ȵķ������������Ʊ���β���е��������������ĵĶ������̵�����Ϊ
6.96
6.96
g����������1����Ӧ����ҺpH����13����Ӧ���������Ƶ�Ũ��Ϊ0.1mol/L������n=cV���㷴Ӧǰ����NaOH�����ʵ������ݴ˼��㣻
��2����д��Ӧ����ʽ�����ݷ���ʽ���㷴Ӧ�����������ݷ���ʽ������������ռ�������㱻�����������ʵ������������㱻��ԭ���������ʵ�����
��3�����ݹ�ϵʽMnO2������Cl2����������̵�������
��2����д��Ӧ����ʽ�����ݷ���ʽ���㷴Ӧ�����������ݷ���ʽ������������ռ�������㱻�����������ʵ������������㱻��ԭ���������ʵ�����
��3�����ݹ�ϵʽMnO2������Cl2����������̵�������
����⣺��1����ӦǰNaOH�����ʵ���Ϊ��0.1 L��1.7 mol/L=0.17mol����Ӧ����ҺpH����13����Ӧ���������Ƶ�Ũ��Ϊ0.1mol/L���ʷ�Ӧ��NaOH�����ʵ���Ϊ��0.1 L��0.1 mol/L=0.01mol�����ĵ�NaOH���ʵ���Ϊ��0.17mol-0.01mol=0.16 mol���ʴ�Ϊ��0.16��
��2��ClO-��ClO3-�����ʵ���Ũ��֮��Ϊ5��1��������ӦΪ8Cl2+16NaOH=5NaClO+NaClO3+10NaCl+8H2O��
��Ӧ����������0.16mol��
=0.08mol��
���б���������������NaClO��NaClO3����Ϊ0.08mol��
=0.03mol��
����ԭ��������Ϊ0.08mol-0.03mol=0.05mol��
�ʴ�Ϊ��0.03��0.05��
��3���ɣ�2����֪��β���е�����Ϊ0.08mol����
MnO2������Cl2
87g 1 mol
m��MnO2�� 0.08mol
��m��MnO2��=87g��
=6.96 g
�ʴ�Ϊ��6.96��
��2��ClO-��ClO3-�����ʵ���Ũ��֮��Ϊ5��1��������ӦΪ8Cl2+16NaOH=5NaClO+NaClO3+10NaCl+8H2O��
��Ӧ����������0.16mol��
| 8 |
| 16 |
���б���������������NaClO��NaClO3����Ϊ0.08mol��
| 6 |
| 16 |
����ԭ��������Ϊ0.08mol-0.03mol=0.05mol��
�ʴ�Ϊ��0.03��0.05��
��3���ɣ�2����֪��β���е�����Ϊ0.08mol����
MnO2������Cl2
87g 1 mol
m��MnO2�� 0.08mol
��m��MnO2��=87g��
| 0.08mol |
| 1mol |
�ʴ�Ϊ��6.96��
���������⿼��������ԭ��Ӧ����ؼ��㣬������ԭ��Ӧ����ؼ����ڻ�ѧ�������ѶȽϴ���Ҫ�����غ㷨���н�𣬱������÷���ʽ���н����Ҫ��д����ʽ�����������⣮

��ϰ��ϵ�д�
�����Ŀ
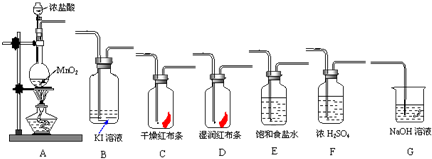

 I���±���ʵ�����Ʊ�������й����ݣ�
I���±���ʵ�����Ʊ�������й����ݣ�