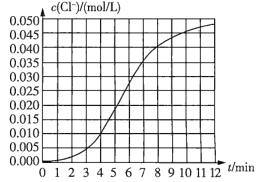
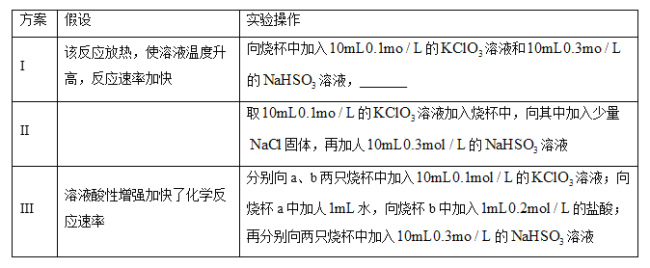
题目内容
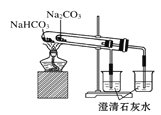
【题目】铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜![]() 含杂质
含杂质![]() 与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
![]() 溶液B经过________、__________、___________可得到氯化铜晶体;
溶液B经过________、__________、___________可得到氯化铜晶体;
![]() 检验溶液B中是否存在
检验溶液B中是否存在![]() 的方法是_________;
的方法是_________;
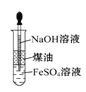
![]() 下列物质适合于调节溶液的pH得溶液B的是________
下列物质适合于调节溶液的pH得溶液B的是________
A.NaOH溶液 ![]()
![]() 氨水
氨水 ![]()
![]() 已知元素在高价态时常表现氧化性,若在酸性
已知元素在高价态时常表现氧化性,若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
【答案】蒸发浓缩 降温结晶 过滤 取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无![]() ,若溶液变红色,则存在
,若溶液变红色,则存在![]()
![]()
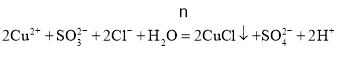
【解析】
粗铜![]() 含杂质
含杂质![]() 与过量氯气反应得FeCl3、CuCl2固体,用稀盐酸溶解得到FeCl3、CuCl2溶液,然后加试剂调节溶液的pH,将Fe3+转化为Fe(OH)3沉淀,从而得到CuCl2溶液。
与过量氯气反应得FeCl3、CuCl2固体,用稀盐酸溶解得到FeCl3、CuCl2溶液,然后加试剂调节溶液的pH,将Fe3+转化为Fe(OH)3沉淀,从而得到CuCl2溶液。
![]() CuCl2溶液经过蒸发、结晶、过滤,可得到氯化铜晶体;
CuCl2溶液经过蒸发、结晶、过滤,可得到氯化铜晶体;
![]() 检验CuCl2溶液中是否存在
检验CuCl2溶液中是否存在![]() 的方法是加入KSCN溶液;
的方法是加入KSCN溶液;
![]() A.加入NaOH溶液,不仅会使Fe3+转化为Fe(OH)3沉淀,也会将Cu2+转化为沉淀,且溶液中引入了Na+;
A.加入NaOH溶液,不仅会使Fe3+转化为Fe(OH)3沉淀,也会将Cu2+转化为沉淀,且溶液中引入了Na+;
![]() ,与溶液中的H+反应,增大溶液的pH,促进Fe3+水解成Fe(OH)3沉淀;
,与溶液中的H+反应,增大溶液的pH,促进Fe3+水解成Fe(OH)3沉淀;
![]() 加入氨水,溶液中会引入NH4+;
加入氨水,溶液中会引入NH4+;
![]() ,与溶液中的H+反应,增大溶液的pH,促进Fe3+水解成Fe(OH)3沉淀。
,与溶液中的H+反应,增大溶液的pH,促进Fe3+水解成Fe(OH)3沉淀。
![]() 若在酸性
若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加热,则Cu2+将SO32-氧化为SO42-,自身被还原为Cu+,Cu+与Cl-结合,生成CuCl沉淀。
和NaCl溶液,加热,则Cu2+将SO32-氧化为SO42-,自身被还原为Cu+,Cu+与Cl-结合,生成CuCl沉淀。
![]() 溶液B为氯化铜溶液,采用蒸发浓缩、降温结晶、过滤,可得到氯化铜晶体。答案为:蒸发浓缩、降温结晶、过滤;
溶液B为氯化铜溶液,采用蒸发浓缩、降温结晶、过滤,可得到氯化铜晶体。答案为:蒸发浓缩、降温结晶、过滤;
![]() 铁离子检验,采用KSCN试剂,操作为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无
铁离子检验,采用KSCN试剂,操作为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无![]() ,若溶液变红色,则存在
,若溶液变红色,则存在![]() 。答案为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无
。答案为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无![]() ,若溶液变红色,则存在
,若溶液变红色,则存在![]() ;
;
![]() 调节溶液pH,可以采用氧化铜、氢氧化铜、或者碳酸铜,消耗氢离子,并且不引入新的杂质。答案为:BD;
调节溶液pH,可以采用氧化铜、氢氧化铜、或者碳酸铜,消耗氢离子,并且不引入新的杂质。答案为:BD;
![]() 硫酸铜与亚硫酸钠发生氧化还原反应,生成氯化亚铜沉淀和硫酸钠,离子方程式为:
硫酸铜与亚硫酸钠发生氧化还原反应,生成氯化亚铜沉淀和硫酸钠,离子方程式为: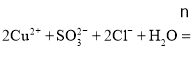
![]() 。答案为:
。答案为: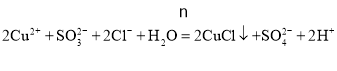 。
。

【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变