题目内容
家用消毒液的发生器是以精盐和自来水为反应物,通电时,发生器电解槽的极板上产生大量气泡,切断电源后,生成液具有强烈的杀菌消毒能力。与该反应器工作原理直接有关的化学方程式是( )。
| A.2NaOH+Cl2=NaCl+NaClO+H2O |
B.H2+Cl2 2HCl 2HCl |
C.2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑ |
| D.2HClO=2HCl+O2↑ |
AC
根据发生器的反应物和反应条件,可以推测在发生器中电解食盐水,C中反应会发生。再根据生成液具有强烈的杀菌消毒能力,结合电解食盐水后的产物可以推断Cl2和NaOH发生反应生成NaClO,A中反应也会发生。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
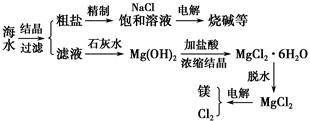
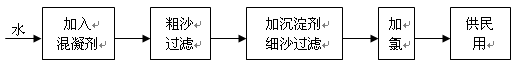
 HCl+HClO K=4.5×10-4
HCl+HClO K=4.5×10-4