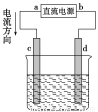
题目内容
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+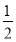 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
则下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ/mol
B.反应①中的能量变化如图所示
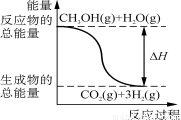
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+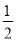 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol
D
【解析】
试题分析:燃烧热是1mol可燃物完全燃烧生成稳定化合物,如氢要生成水,故A错误;右图所示的是放热反应,B错误;CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,故C错误;反应②甲醇反应生成二氧化碳和氢气的焓变是﹣192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水放出的热量大于192.9 kJ;故D正确;选D。
考点:本题考查了热化学方程式的书写和注意问题,利用热化学方程式进行分析判断反应的热效应,计算反应热量变化。

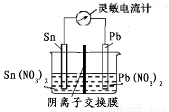
现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性; C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是 (用离子方程式表示)。
(2)写出E溶液与过量的B溶液反应的离子方程式 。
(3)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子
浓度 倍。
(4)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或-1)
浓度由大到小的顺序为: 。