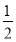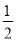题目内容
下列液体均处于25℃,下列有关叙述正确的是( )
A.PH值相同的盐酸和氯化铵溶液中水的电离程度相同
B.某溶液中由水电离出的c(H+)=10-13,则该溶液的PH一定为13
C.PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的2倍
D.中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1
D
【解析】
试题分析:A、盐酸抑制水的电离,氯化铵水解促进水的电离,PH值相同的盐酸和氯化铵溶液中水的电离程度前者小于后者,错误;B、某溶液中由水电离出的c(H+)=10-13,说明水的电离受到抑制,外加酸或碱均抑制水的电离,则该溶液的PH可能为1或13,错误;C、PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的100倍,D、浓度和体积均相同的盐酸和醋酸中溶质的物质的量相同,中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1,正确。
考点:考查电解质溶液,涉及水的电离、PH计算及酸碱中和反应。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目