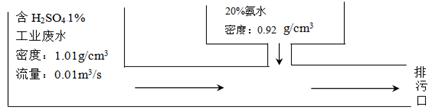
题目内容
(6分) 5.3g Na2CO3正好与20mL盐酸完全反应(Na2CO3+2HCl=2NaCl+CO2↑+H2O)。问这种盐酸的物质的量浓度c(HCl)=________________________产生的CO2在标准状况下的体积V(CO2)="_____________________"
5 mol/L 1.12 L (每空3分,单位不对,扣1分)
5.3g碳酸钠的物质的量是5.3g÷106g/mol=0.05mol。根据方程式可知,消耗1mol碳酸钠的同时必然消耗2mol氯化氢,所以参加反应的氯化氢的物质的量是0.05mol×2=0.1mol,因此元素的浓度是0.1mol÷0.02L=5mol/L。生成CO2的物质的量是0.05mol,标准状况下的体积是0.05mol×22.4L/mol=1.12L。

练习册系列答案
相关题目