题目内容
【题目】某研究小组利用如图所示的装置,进行CO还原Fe2O3的实验(固定装置略)。
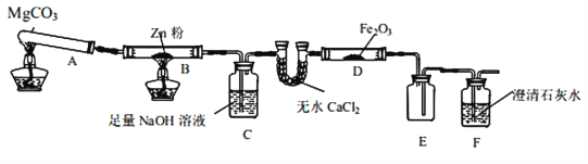
(1)装置B中发生的化学方程式________________。装置C的作用是__________________________
(2)用酒精喷灯对装置D加热,得到灰黑色粉末用黑色粉末进行以下实验:
步骤 | 操作 | 现象 |
1 | 取灰黑色粉末加入稀硫酸 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加NaOH溶液后,在空气中,搅拌放置 | 白色沉淀最终变为红褐色 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水至过量 | 先变红,后褪色 |
①得到的灰黑色粉末是________________(填写化学式)。
②步骤2中“白色沉淀最终变为红褐色”的化学反应方程式为_________________。
③步骤4中,溶液变红的原因为_____________________________________________________________;溶液褪色可能的原因______________________________________;验证上述原因的实验操作方法为____________。
(3)上述装置,从实验安全考虑,需要采取的改进措施是________。
【答案】Zn+CO2![]() ZnO+CO 除去多余CO2 Fe(可能含FeO) 4Fe(OH)2+O2+2H2O→4Fe(OH)3 Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色 SCN-可能被Cl2氧化 取上述褪色后的溶液少量,再滴加入KSCN溶液,若出现红色,则证明上述假设成立 在装置BC之间添加装置E,以防至倒吸,在装置F末端增加尾气吸收装置
ZnO+CO 除去多余CO2 Fe(可能含FeO) 4Fe(OH)2+O2+2H2O→4Fe(OH)3 Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色 SCN-可能被Cl2氧化 取上述褪色后的溶液少量,再滴加入KSCN溶液,若出现红色,则证明上述假设成立 在装置BC之间添加装置E,以防至倒吸,在装置F末端增加尾气吸收装置
【解析】
A中发生的化学方程式是MgCO3![]() MgO+CO2↑,实验时B中发生的化学方程式是
MgO+CO2↑,实验时B中发生的化学方程式是
CO2+Zn![]() ZnO+CO,装置C的作用是除去CO中CO2,经无水CaCl2干燥后,在D中进行CO还原Fe2O3,E中收集CO,F中除去CO2。
ZnO+CO,装置C的作用是除去CO中CO2,经无水CaCl2干燥后,在D中进行CO还原Fe2O3,E中收集CO,F中除去CO2。
(1)装置B中锌将CO2还原,发生的化学方程式 Zn+CO2![]() ZnO+CO。结合实验目的可知在装置B处,CO2与Zn作用生成CO气体,进入后面装置进行实验,故装置C中NaOH是用来吸收CO中混有的CO2气体;
ZnO+CO。结合实验目的可知在装置B处,CO2与Zn作用生成CO气体,进入后面装置进行实验,故装置C中NaOH是用来吸收CO中混有的CO2气体;
(2)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;
②步骤2中“白色沉淀最终变为红褐色”是氢氧化亚铁被空气中氧气氧化所致,化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 。
③因Fe3+遇SCN-显红色,步骤4中,溶液变红的原因为Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色 ;溶液褪色可能的原因SCN-可能被Cl2氧化 ;验证上述原因的实验操作方法为取上述褪色后的溶液少量,再滴加入KSCN溶液,若出现红色,则证明上述假设成立。
(3)上述装置,从实验安全考虑,需要采取的改进措施是:若B处停止加热后,C中液体易倒吸入B中引起玻璃管炸裂,因此可采取的改进措施是在装置BC之间添加装置E防倒吸,在装置F末端增加尾气吸收装置。

【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |


