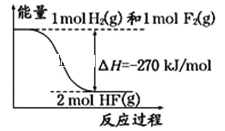
题目内容
【题目】按要求回答以下问题:
Ⅰ.认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为________。连接装置B、C的U形管中装填含有琼脂的KCl饱和溶液,其作用是______。
(2)装置A中总反应的离子方程式为___________________。
(3)若装置E的目的是在Cu材料上镀银,则X为_____,极板N的材料为_____。
(4)装置D中NaCl溶液的pH会__________。(填“增大”“减小”“不变”)
Ⅱ.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为____________。
Ⅲ.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
(1)图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量___mol;请用方程式解释阴极区pH增大的原因:___________。

【答案】PbO2+4H++SO42-+2e-=PbSO4+2H2O 使装置B、C中的溶液连成通路,平衡电荷 Cu+2H+![]() Cu2++H2↑ AgNO3 Ag 增大 O2+4e-=2O2- Cl--5e-+2H2O=ClO2↑+4H+ 0.01 2H2O+2e-=H2↑+2OH-
Cu2++H2↑ AgNO3 Ag 增大 O2+4e-=2O2- Cl--5e-+2H2O=ClO2↑+4H+ 0.01 2H2O+2e-=H2↑+2OH-
【解析】
根据原电池工作原理和电解原理进行分析。
I.(1)装置B和装置C构成的是原电池,PbO2为正极,电解反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O,Pb为负极,电极反应式为Pb+SO42--2e-=PbSO4,盐桥的作用是使装置B和C构成闭合回路,平衡电荷;
(2)根据电解原理,Cu电极为阳极,Pt电极为阴极,阳极反应式为Cu-2e-=Cu2+,阴极反应式为2H++2e-=H2↑,因此装置A总反应为Cu+2H+![]() Cu2++H2↑;
Cu2++H2↑;
(3)根据电镀的原理,待镀金属作阴极,镀层金属作阳极,Cu材料上镀Ag,即Cu作阴极,Ag作阳极,AgNO3为电解质溶液,极板M为阴极,极板N为阳极,即X为AgNO3溶液,极板N为Ag;
(4)电解饱和食盐水的总反应是2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,c(OH-)增大,溶液的pH增大;
2NaOH+H2↑+Cl2↑,c(OH-)增大,溶液的pH增大;
II.根据题中信息,电解质在高温下传导O2-,因此正极反应式为O2+4e-=2O2-;
III.(1)阳极上产生ClO2,根据电解原理,Cl-在阳极上放电,即电极反应式为Cl-+2H2O-5e-=ClO2↑+4H+;
(2)根据电解原理,阴极反应式为2H2O+2e-=H2↑+2OH-,产生H2的体积112mL,转移电子物质的量为112×10-3L÷22.4L/mol×2=0.01mol,因此通过阳离子的物质的量为0.01mol,根据阴极反应式,c(OH-)增大,pH增大。

【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1=-285.8kJ/mol
C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH3=-5518kJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
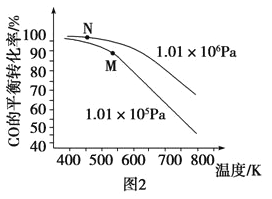
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图所示。

①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为__________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
③工业实际合成CH3OH生产中,采用图2中M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由_________________________。