题目内容
对于可逆反应 A(气)+2B(气) 2C(气)+Q的平衡体系,下列说法错误的是
2C(气)+Q的平衡体系,下列说法错误的是
A.增大压强,正、逆反应的速率(v正和v逆)都增大,v正增大的倍数大于v逆增大的倍数
B.降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数
C.使用催化剂,v正、v逆都改变,变化的倍数相同
D.扩大容器体积,容器内A、B、C物质的量都不变
 2C(气)+Q的平衡体系,下列说法错误的是
2C(气)+Q的平衡体系,下列说法错误的是 A.增大压强,正、逆反应的速率(v正和v逆)都增大,v正增大的倍数大于v逆增大的倍数
B.降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数
C.使用催化剂,v正、v逆都改变,变化的倍数相同
D.扩大容器体积,容器内A、B、C物质的量都不变
B、D
本题主要讨论的是对化学反应速率影响的四个因素,即温度、压强、浓度和催化剂。在备选答案中对这四个因素均有所讨论。
①温度“升高温度”,正、逆反应速率都会增大,只不过对于是吸热反应还是放热反应增大的程度不</PGN0078B.TXT/PGN>同,具体到本题正反应为放热反应v正增大的倍数小于v逆增大的倍数,D项说法正确,但不是本题要求答案。B的说法,速率都减小是对的,但v正减小的倍数应小于v逆的倍数,所以B项说法错误,是本题要求的答案。
②压强:对于有气体参加的反应,改变压强,实质是改变浓度,反应物和产物的浓度都增加了,从反应式的各物质系数看,增大的倍数不同,反应物浓度增大的多,所以v正的速率增大的倍数大于v逆增大的倍数,A项正确,不是答案。
③扩大容器的体积等于减小压强,从而减小了体系内物质的浓度,正、逆反应速率必定改变不同,所以,A、B、C物质的量不变是不正确的,D为答案。
④催化剂使正、逆反应速率改变倍数相同,可使达到平衡的时间缩短,所以C项正确。不是本题答案。
①温度“升高温度”,正、逆反应速率都会增大,只不过对于是吸热反应还是放热反应增大的程度不</PGN0078B.TXT/PGN>同,具体到本题正反应为放热反应v正增大的倍数小于v逆增大的倍数,D项说法正确,但不是本题要求答案。B的说法,速率都减小是对的,但v正减小的倍数应小于v逆的倍数,所以B项说法错误,是本题要求的答案。
②压强:对于有气体参加的反应,改变压强,实质是改变浓度,反应物和产物的浓度都增加了,从反应式的各物质系数看,增大的倍数不同,反应物浓度增大的多,所以v正的速率增大的倍数大于v逆增大的倍数,A项正确,不是答案。
③扩大容器的体积等于减小压强,从而减小了体系内物质的浓度,正、逆反应速率必定改变不同,所以,A、B、C物质的量不变是不正确的,D为答案。
④催化剂使正、逆反应速率改变倍数相同,可使达到平衡的时间缩短,所以C项正确。不是本题答案。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
 2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是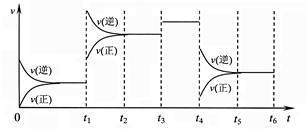
 B+3C处于平衡状态的是( )
B+3C处于平衡状态的是( ) 4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示); C(气)+D(气)
C(气)+D(气) 2C(g),2 min后,参加反应的各物质的浓度分别为c(A)="0.5" mol ·L-1,c(B)="0.75" mol ·L-1,c(C)="0.5" mol ·L-1,试计算A和B起始的物质的量。
2C(g),2 min后,参加反应的各物质的浓度分别为c(A)="0.5" mol ·L-1,c(B)="0.75" mol ·L-1,c(C)="0.5" mol ·L-1,试计算A和B起始的物质的量。  MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是( )。
MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是( )。