题目内容
12.对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=a kJ•mol -1,若增大压强平衡向正反应方向移动,则a+b> c+d(填“>”或“<”);若升高温度,平衡向正反应方向移动,则a>0(填“>”或“<”)分析 增大压强,平衡向正反应方向移动,则反应物中的化学计量数之和大于生成物中化学计量数之和;升高温度,平衡向着吸热的反应方向移动,据此进行解答.
解答 解:对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=a kJ•mol -1,增大压强平衡向正反应方向移动,则反应物中的化学计量数之和大于生成物中化学计量数之和,即a+b>c+d;
若升高温度,平衡向正反应方向移动,说明正反应为吸热反应,则a>0,
故答案为:>;>.
点评 本题考查化学平衡的影响因素,题目难度不大,明确温度、压强对反应速率的影响为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
1. 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | Cl2 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | NaOH溶液 | AlCl3溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.以下物质;(1)溴乙烷;(2)苯;(3)聚氯乙烯;(4)裂化汽油;(5)聚1,3-丁二烯;(6)乙二醇;(7)邻二甲苯(8)亚硫酸氢钠;既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
19.将一定质量的乙炔(化学式为C2H2)和氧气放在密闭的容器中点燃,测得反应前后各物质的质量如下表:
该反应的化学方程式为4C2H2+9O2$\stackrel{点燃}{→}$4H2O+6CO2+2CO;若要使燃烧后无M生成,则需要氧气的质量为1.6g.
| 物质 | 乙炔 | 氧气 | 水 | 二氧化碳 | M |
| 反应前质量/g | 5.2 | 14.4 | 0.4 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 4.0 | m | 2.8 |
7.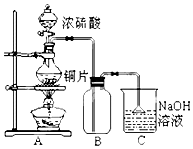 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000mL,取20.00mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是不能,pH>5时,铜离子与碱反应生成沉淀,不能达到滴定终点.
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
17.常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| C. | pH=4的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) | |
| D. | 将pH=6的H2SO4稀释1000倍后,c(H+)=2 c(SO42-) |
1.用N0表示阿伏加德罗常数的值,下列说法中不正确的是( )
| A. | 将氯气通入足量氢氧化钠溶液中,当消耗4nmolNaOH时,反应中转移的电子为4nN0 | |
| B. | 4.4g由N2O和CO2组成的混合气体含0.3N0个原子 | |
| C. | 23.4gNaCl晶体中含0.1N0个如图所示的结构单元 | |
| D. | 7.8gNa2O2与足量潮湿的CO2反应,转移的电子数为0.1N0 |