题目内容
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+ CaCl2+ 2H2SO4 ![]() 2CaSO4 + 2Cl2↑+ 2H2O,他们设计如下实验用于制取氯气并验证其性质。
2CaSO4 + 2Cl2↑+ 2H2O,他们设计如下实验用于制取氯气并验证其性质。

试回答:
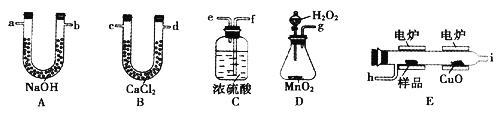
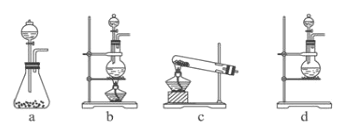
(1)该实验中A部分的装置是________(填写装置的序号)。
(2)B中的实验现象为___________________________ 。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因,_____________________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)_____________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质______。
【答案】b 溶液由无色变为黄色或棕褐色(或变成黄色后褪色,有学生想到氯气会继续和碘反应) SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+ 从C中取出少量溶液至小试管中,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化 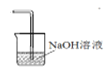
【解析】
化学方程式为Ca(ClO)2+CaCl2+H2SO4![]() 2CaSO4+2Cl2↑+2H2O,应在加热的条件下反应,氯气具有强氧化性,可与KI反应生成I2,可将亚硫酸钠氧化成硫酸钠,氯气有毒,不能排放到空气中,由于可与碱反应,则可用NaOH溶液进行尾气的吸收,以此解答该题。
2CaSO4+2Cl2↑+2H2O,应在加热的条件下反应,氯气具有强氧化性,可与KI反应生成I2,可将亚硫酸钠氧化成硫酸钠,氯气有毒,不能排放到空气中,由于可与碱反应,则可用NaOH溶液进行尾气的吸收,以此解答该题。
(1)由方程式可知反应为固体和液体的反应,应在加热的条件下反应,应用装置b进行制备,故答案为:b;
(2)装置B中发生反应的离子方程式为Cl2+2I-=I2+2Cl-,实验现象为溶液由无色变为黄色或棕褐色(或变成黄色后褪色,过量的氯气会继续和碘反应生成HCl和HIO3);
(3)C中亚硫酸钠被氯气氧化生成硫酸钠,反应的离子方程式为SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+;设计实验证明洗气瓶C中的亚硫酸钠已被氧化,即证明有硫酸钠生成,实验操作为从C中取出少量溶液至小试管中,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化;
(4)氯气有毒,不能排放到空气中,由于可与碱反应,则可用NaOH溶液进行尾气的吸收,D处的实验装置图可为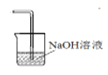 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案