题目内容
(15分)1、已知X、Y、Z、W为四种短周期主族元素,它们的原子序数依次增大,其中X、Y、W位于不同周期,Y是形成化合物种类最多的元素,Z可形成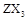 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。
(1)由X、Y组成的最简单化合物可作为某燃料电池的 极反应物。
(2)化合物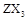 所含化学键种类为
所含化学键种类为  ,属于 化合物(填
,属于 化合物(填 “离子”或“共价”)。
“离子”或“共价”)。
(3)写出实验室制备W单质的化学方程式为 。
Ⅱ、铁及其化合物在生活、生产中有广泛应用。请回答下 列问题:
列问题:
(1) 黄铁矿(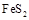 )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为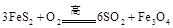 ,有3mol
,有3mol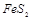 参加反应,转移 mol电子。
参加反应,转移 mol电子。
氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(2) 与明矾相似,硫酸铁也可用作净水剂,其原理是 。
。
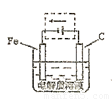
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。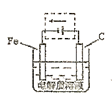
(15分)I(1)负(1分) (2)共价键(1分),共价(1分)
(3)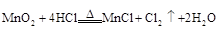 (2分)
(2分)
Ⅱ、(1)32(2分)(2)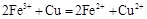 (2分)铁粉、稀盐酸(稀硫酸)(2分)
(2分)铁粉、稀盐酸(稀硫酸)(2分)
(3)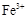 水解:
水解: 生成有吸附作用的
生成有吸附作用的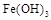 胶体,吸附水中悬附物一起沉淀从而净水(2分)
胶体,吸附水中悬附物一起沉淀从而净水(2分)
(4) (2分)
(2分)
解析

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如表:
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是 .
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).
②M是含有 键的 分子(填“极性”或“非极性”)
③N是一种易液化的气体,请简述其易液化的原因 .
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 .
⑤AB-离子中和B2分子的π键数目比为 .
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为 (填代号)
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为 .
③G2+离子的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 .
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2754 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为
②M是含有
③N是一种易液化的气体,请简述其易液化的原因
④W分子的VSEPR模型的空间构型为
⑤AB-离子中和B2分子的π键数目比为
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为
③G2+离子的核外电子排布式为
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
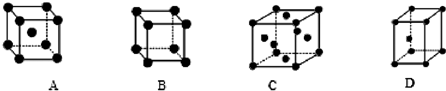
①三种元素在周期表中位于第 周期
②X晶体采用的堆积方式是下列中 (填字母)
(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是 .
(3)N2O的等电子体为:①分子 ,②阴离子 ;由此可知N2O的中心原子的杂化类型为 .根据价层电子对互斥模型确定NO2的分子构型为 .
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.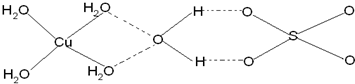
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
②X晶体采用的堆积方式是下列中

(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是
(3)N2O的等电子体为:①分子
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.

 下列是部分金属元素的电离能
下列是部分金属元素的电离能 )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。 )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为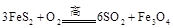 ,有3mol
,有3mol 参加反应,转移
mol电子。
参加反应,转移
mol电子。