题目内容
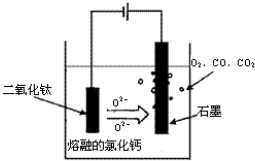
如图所示,甲、乙是电化学实验装置,请回答下列问题

(1)若甲、乙两个烧杯中均盛放饱和NaCl溶液。
①甲中石墨棒上的电极反应式是____________。
②将湿润的淀粉KI试纸放在乙烧杯的上方,发现试纸先变蓝后褪色,这是因为电解生成的某种气体A氧化了I-生成了I2。若A气体和I2按物质的量之比为5:1反应,且生成两种酸,该反应的化学方程式为____________________
③如果不考虑气体产物与烧杯中溶液之间的反应,当乙反应有0.01mol电子转移后停止实验,烧杯中溶液的体积为100 mL,则溶液混匀后的pH=____。
(2)若甲、乙两烧杯中均盛放CuSO4溶液。
①甲中铁棒上的电极反应式为________。
②乙中总反应的离子方程式为____________________。
③如果起始时乙中盛放100 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入____(填写物质的化学式)____g,
①甲中石墨棒上的电极反应式是____________。
②将湿润的淀粉KI试纸放在乙烧杯的上方,发现试纸先变蓝后褪色,这是因为电解生成的某种气体A氧化了I-生成了I2。若A气体和I2按物质的量之比为5:1反应,且生成两种酸,该反应的化学方程式为____________________
③如果不考虑气体产物与烧杯中溶液之间的反应,当乙反应有0.01mol电子转移后停止实验,烧杯中溶液的体积为100 mL,则溶液混匀后的pH=____。
(2)若甲、乙两烧杯中均盛放CuSO4溶液。
①甲中铁棒上的电极反应式为________。
②乙中总反应的离子方程式为____________________。
③如果起始时乙中盛放100 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入____(填写物质的化学式)____g,
(1)①O2+4e-+2H2O=4OH-;②5Cl2+I2+6H2O=10HCl+2HIO3;③13
(2)①Fe-2e-=Fe2+;②2Cu2++2H2O 2Cu↓+4H++O2↑;③CuO(或CuCO3);0.4(或0.62)
2Cu↓+4H++O2↑;③CuO(或CuCO3);0.4(或0.62)
(2)①Fe-2e-=Fe2+;②2Cu2++2H2O
 2Cu↓+4H++O2↑;③CuO(或CuCO3);0.4(或0.62)
2Cu↓+4H++O2↑;③CuO(或CuCO3);0.4(或0.62) 
练习册系列答案
相关题目
从含有Ag+、Fe3+和Al3+的溶液中,按如图所示方法分离提取金属单质.已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取.对该实验过程的分析正确的是( )


| A、丙是NaOH,丁是稀H2SO4 | B、乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来 | C、操作I是过滤和洗涤沉淀.洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次 | D、g是氧化物,金属c采用电解法获得 |
 (2013?德州一模)【化学一物质结构与性质】
(2013?德州一模)【化学一物质结构与性质】



 C6H12O6(葡萄糖)+6O2。
C6H12O6(葡萄糖)+6O2。