题目内容
【题目】某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备![]() 已知某化工厂的含镍催化剂主要含有Ni,还含有
已知某化工厂的含镍催化剂主要含有Ni,还含有![]() 、
、![]() 的单质及氧化物,其他不溶杂质
的单质及氧化物,其他不溶杂质![]() 。
。

部分阳离子以氢氧化物形式沉淀时的pH如表所示:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 加入
加入![]() 时发生反应的离子方程式______。
时发生反应的离子方程式______。
![]() 操作b为调节溶液的pH,你认为pH的调控范围是______。
操作b为调节溶液的pH,你认为pH的调控范围是______。
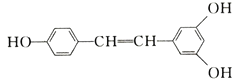
![]() 产品晶体中混有少量绿矾
产品晶体中混有少量绿矾![]() ,其原因可能是______
,其原因可能是______![]() 写出一点即可
写出一点即可![]() 。为了测定产品的纯度,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用
。为了测定产品的纯度,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用![]() 的酸性
的酸性![]() 标准液滴定,直到______为止,重复以上操作两次,消耗酸性
标准液滴定,直到______为止,重复以上操作两次,消耗酸性![]() 溶液体积的平均值为
溶液体积的平均值为![]() 不被氧化
不被氧化![]() ,则该产品晶体的纯度是______。
,则该产品晶体的纯度是______。![]() 结果保留3位有效数字
结果保留3位有效数字![]() 的摩尔质量为
的摩尔质量为![]()
![]() 可用于制备镍氢电池
可用于制备镍氢电池![]() ,NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是
,NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是![]() ,则NiMH电池放电过程中正极的电极反应式为______。
,则NiMH电池放电过程中正极的电极反应式为______。
【答案】![]()
![]()
![]() 的用量不足
的用量不足![]() 或
或![]() 失效
失效![]() 、保温时间不足导致
、保温时间不足导致![]() 未被完全氧化造成的 滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色
未被完全氧化造成的 滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色 ![]()
![]()
【解析】
含镍催化剂主要含有Ni,还含有![]() 、
、![]() 的单质及氧化物,其他不溶杂质
的单质及氧化物,其他不溶杂质![]() 。碱浸后,过滤得到固体加入酸浸,过滤,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液
。碱浸后,过滤得到固体加入酸浸,过滤,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液![]() 防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到
防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到![]() 晶体,以此解答该题。
晶体,以此解答该题。
![]() 过氧化氢具有强氧化性,可与亚铁离子发生氧化还原反应,反应的离子方程式为
过氧化氢具有强氧化性,可与亚铁离子发生氧化还原反应,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 依据图表中沉淀需要的溶液PH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液PH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在
依据图表中沉淀需要的溶液PH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液PH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在![]() 间,故答案为:
间,故答案为:![]() ;
;
![]() 产品晶体中有时会混有少量绿矾
产品晶体中有时会混有少量绿矾![]() ,说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化,用
,说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化,用![]() 的酸性
的酸性![]() 标准液滴定,滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,说明达到滴定终点,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用
标准液滴定,滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,说明达到滴定终点,某同学称取50克该产品晶体配成100mL溶液,取20mL该溶液于锥形瓶中,然后用![]() 的酸性
的酸性![]() 标准液滴定,消耗酸性
标准液滴定,消耗酸性![]() 溶液体积的平均值为
溶液体积的平均值为![]() 不被氧化
不被氧化![]() ,则
,则![]() ,反应中Fe元素化合价由
,反应中Fe元素化合价由![]() 价升高到
价升高到![]() 价,Mn元素化合价由
价,Mn元素化合价由![]() 价降低到
价降低到![]() 价,则有关系式
价,则有关系式![]() ,可知样品中
,可知样品中![]() ,则该产品晶体的纯度是
,则该产品晶体的纯度是![]() ,故答案为:
,故答案为:![]() 的用量不足
的用量不足![]() 或
或![]() 失效
失效![]() 、保温时间不足导致
、保温时间不足导致![]() 未被完全氧化造成的;滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;
未被完全氧化造成的;滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;![]() ;
;
![]() 电池放电过程中,正极上NiOOH得电子生成
电池放电过程中,正极上NiOOH得电子生成![]() ,则正极的电极方程式为:
,则正极的电极方程式为:![]() 。
。