题目内容
下列有关平衡常数的说法正确的是
A.已知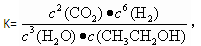 则对应的化学反应可以表示为: 则对应的化学反应可以表示为:2CO2(g) + 6H2(g) 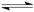 CH3CH2OH(g) + 3H2O(g) CH3CH2OH(g) + 3H2O(g) |
| B.将某浓度醋酸溶液升高温度,醋酸的电离平衡常数Ka将变大 |
| C.常温下,向纯水中加入少量碳酸钠固体,水的电离程度变大,Kw变大 |
D.常温下,在饱和氯水中加入少量碳酸钙固体,Cl2+H2O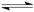 HCl+HClO平衡正移,平衡常数K变大 HCl+HClO平衡正移,平衡常数K变大 |
B
A、分子为生成物,分母为反应物;
B、电离吸热,温度升高,电离常数变大;
C、Kw只与温度有关,温度不变,Kw不变;
D、K只与温度有关,温度不变,K不变;
B、电离吸热,温度升高,电离常数变大;
C、Kw只与温度有关,温度不变,Kw不变;
D、K只与温度有关,温度不变,K不变;

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
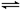 Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g) cC(g)表示]化学平衡的影响,得到如图所示图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):
cC(g)表示]化学平衡的影响,得到如图所示图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):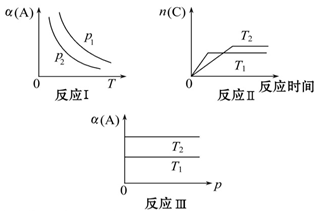
 2AB3(g)化
2AB3(g)化

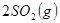
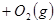

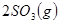 从正方向开始,并达到了平衡,此时
从正方向开始,并达到了平衡,此时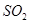 和
和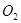 的物质的量之比为2:1,若采取某种措施,导致
的物质的量之比为2:1,若采取某种措施,导致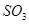 的浓度肯定增大
的浓度肯定增大 4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是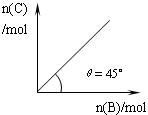
 N2O4(g)△H=-57.2kJ·mol-1
N2O4(g)△H=-57.2kJ·mol-1
 大于”、“小”或“等于”)
大于”、“小”或“等于”) 不变,下列既能加快正反应速率又能提高NO2转化率的措施是
不变,下列既能加快正反应速率又能提高NO2转化率的措施是 醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:
醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应: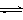 CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol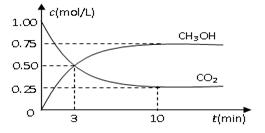
 _____;
_____; 为__________;
为__________; _____________________。
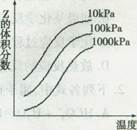
_____________________。 Z反应影响的示意图,下列叙述正确的是
Z反应影响的示意图,下列叙述正确的是