题目内容
下列溶液中,有关物质的量浓度关系正确的是
A.室温下,向10 mL pH=3.0的醋酸溶液中加入水稀释后,溶液中 将要变小
将要变小
B.pH=8.0的KHS溶液中,c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c (A-)=2c(H+)+c(HA)
D.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(NH3·H2O)<c(HCl)
C
解析试题分析:A、醋酸溶液中醋酸的电离常数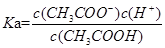 ,水的离子积常数
,水的离子积常数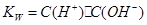 ,
, 也为常数与浓度无关,错误;B、KHS溶液中,存在HS-
也为常数与浓度无关,错误;B、KHS溶液中,存在HS- S2-+ H+,同时H2O
S2-+ H+,同时H2O H++OH-,故c(S2-)< c(H+),错误;C、根据题意两者的混合溶液相当于等浓度的HA和NaA混合溶液,存在①电荷守恒:H++ Na+ = A-+OH-,②物料守恒2Na+ ="HA+" A-,由①×2-②=2c(OH-)+c (A-)=2c(H+)+c(HA)为质子守恒式,正确;D、假设c(NH3·H2O)=c(HCl),混合后得到NH4Cl溶液,由于NH4+水解溶液显酸性,若要所得溶液呈中性,需NH3·H2O过量,即 c(NH3·H2O)>c(HCl),错误。
H++OH-,故c(S2-)< c(H+),错误;C、根据题意两者的混合溶液相当于等浓度的HA和NaA混合溶液,存在①电荷守恒:H++ Na+ = A-+OH-,②物料守恒2Na+ ="HA+" A-,由①×2-②=2c(OH-)+c (A-)=2c(H+)+c(HA)为质子守恒式,正确;D、假设c(NH3·H2O)=c(HCl),混合后得到NH4Cl溶液,由于NH4+水解溶液显酸性,若要所得溶液呈中性,需NH3·H2O过量,即 c(NH3·H2O)>c(HCl),错误。
考点:考查电解质溶液离子浓度大小判断、各种常数及三大守恒的应用。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)> c(OH-)>c(H+) |
某温度下, pH值相同的盐酸和氯化铵溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是( )
| A.Ⅱ为氯化铵稀释时pH值变化曲线,a点水的电离程度大于c点水的电离程度 |
| B.b点溶液中水的电离程度比c点溶液中水的电离程度大,且两点的KW相同 |
| C.a点时,等体积的两溶液与NaOH反应消耗的NaOH量相同 |
| D.加入足量NaOH,b点溶液消耗的NaOH比d点溶液消耗的多 |
草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是( )
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c(C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5
| A.①③④ | B.①② | C.②④ | D.② |
已知25℃时,AgCl的溶度积 ,则下列说法正确的是:
,则下列说法正确的是:
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有 |
C.温度一定时,当溶液中 时,此溶液中必有AgCl的沉淀析出 时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。
某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
(1)酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号)。
| A.醋酸 | B.盐酸 | C.硝酸 | D.稀硫酸 |
(3)洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的SnCl2溶液,反应中的Sn2+与Fe3+的物质的量之比为1∶2,Sn2+转化为 (填离子符号)。
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图
所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 。
调节柠檬酸溶液的pH=4,有利于除去水垢中的氧化铁。pH=4时,溶液中上述4种微粒含量最多的是 。

