题目内容
已知X、Y、Z、M、W、R是前四周期中的六种元素.X元素原子形成的离子是一个质子,Y原子的价电子构型为2s22p2,Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的.
(1)24R原子最外层的电子排布图是 ,ZO3-的空间构型是 ;
(2)Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是 ;Y、Z、W三种元素的电负性由大到小的顺序是 .(填元素符号)
(3)Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是 .(填化学式)
(4)ZX4W在物质中,各种粒子间的相互作用力包括 .(填字母编号)
A.非极性共价键 B.极性共价键 C.配位键 D.离子键 E.氢键.
(1)24R原子最外层的电子排布图是
(2)Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是
(3)Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是
(4)ZX4W在物质中,各种粒子间的相互作用力包括
A.非极性共价键 B.极性共价键 C.配位键 D.离子键 E.氢键.
分析:X、Y、Z、M、W、R是前四周期中的六种元素.X元素原子形成的离子是一个质子,则X为H元素;Y原子的价电子构型为2s22p2,则Y为C元素;Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的,则Z为N元素.根据(1)中原子符号24R,可知R为24号元素Cr;根据(3)中Ne与Wn-的电子数相同,核外电子数为10,W所在族的各元素的氢化物的水溶液均显酸性,处于ⅦA族,则W为F元素;结合(2)中Z、M、W原子序数依次增大,推断M为O元素,据此解答.
解答:解:X、Y、Z、M、W、R是前四周期中的六种元素.X元素原子形成的离子是一个质子,则X为H元素;Y原子的价电子构型为2s22p2,则Y为C元素;Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的,则Z为N元素.根据(1)中原子符号24R,可知R为24号元素Cr;根据(3)中Ne与Wn-的电子数相同,核外电子数为10,W所在族的各元素的氢化物的水溶液均显酸性,处于ⅦA族,则W为F元素;结合(2)中Z、M、W原子序数依次增大,推断M为O元素,
(1)R为24号元素Cr,最外层的电子排布图是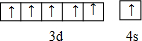 ,ZO3-为NO3-,N原子价层电子对数=3+
,ZO3-为NO3-,N原子价层电子对数=3+
=3、N原子没有孤对电子,则其空间构型为平面三角形,
故答案为: ;平面三角形;
;平面三角形;
(2)同周期自左而右第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能F>N>O,同周期随原子序数增大电负性增大,故电负性F>N>C,
故答案为:F>N>O;F>N>C;
(3)W所在族为ⅦA族,氢化物中HF分子之间存在氢键,氢键比分子间作用力强,故同主族氢化物中中HF的沸点最高,故答案为:HF;
(4)ZX4W为NH4F,属于离子化合物,含有离子键,铵根离子中N原子与H原子之间形成极性键、配位键,故答案为:BCD.
(1)R为24号元素Cr,最外层的电子排布图是
 ,ZO3-为NO3-,N原子价层电子对数=3+
,ZO3-为NO3-,N原子价层电子对数=3+| 5+1-2×3 |
| 2 |
故答案为:
 ;平面三角形;
;平面三角形;(2)同周期自左而右第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能F>N>O,同周期随原子序数增大电负性增大,故电负性F>N>C,
故答案为:F>N>O;F>N>C;
(3)W所在族为ⅦA族,氢化物中HF分子之间存在氢键,氢键比分子间作用力强,故同主族氢化物中中HF的沸点最高,故答案为:HF;
(4)ZX4W为NH4F,属于离子化合物,含有离子键,铵根离子中N原子与H原子之间形成极性键、配位键,故答案为:BCD.
点评:本题考查结构物质性质关系应用,涉及核外电子排布、电离能、电负性、化学键等,难度中等,推断元素是解题关键,注意需要结合问题中信息进行推断.

练习册系列答案
相关题目
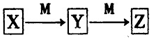 已知X、Y、Z、M均为中学常见单质或化合物,它们之间存在如图所示转化关系(部分产物略去).上述转化中X可能是下列物质中的( )
已知X、Y、Z、M均为中学常见单质或化合物,它们之间存在如图所示转化关系(部分产物略去).上述转化中X可能是下列物质中的( )