题目内容
I、表中①~⑥为部分短周期元素的化合价及原子半径
|
元素性质[ |
元素编号[来源:学*科*网Z*X*X*K] |
|||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
原子半径/nm |
0.102 |
0.110 |
0.074 |
0.075 |
0.071 |
0.099 |
|
最高化合价 |
+6 |
+5 |
|
+5 |
|
+7 |
|
最低化合价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
(1)第二周期第ⅥA族 (2) 
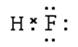
(3) ab
(4)2SO2+O2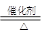 2SO3 4NH3+5O2
2SO3 4NH3+5O2 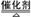 4NO+6H2O
4NO+6H2O
【解析】考查元素周期律的应用。根据所给的化合价和原子半径结合元素周期律可推断出①~⑥分别为S、P、O、N、F、Cl。常见化合物CB2、CB3 和AB、AB2的分别是SO2、SO3和NO、NO2.即ABC分别是S、O、N。甲、乙均是中学常见强酸,故为硫酸和硝酸。浓硫酸具有吸水性,浓硝酸具有挥发性,在常温下和铁发生钝化。铜和浓硫酸反应需要加热,稀硫酸没有强氧化性,所以正确的是ab。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质[ | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合价 | +6 | +5 |
| +5 |
| +7 |
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质[ | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合价 | +6 | +5 |
| +5 |
| +7 |
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质[ | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合价 | +6 | +5 |
| +5 |
| +7 |
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
I、表中①~⑥为部分短周期元素的化合价及原子半径
|
元素性质[ |
元素编号[来源:学*科*网Z*X*X*K] |
|||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
原子半径/nm |
0.102 |
0.110 |
0.074 |
0.075 |
0.071 |
0.099 |
|
最高化合价 |
+6 |
+5 |
|
+5 |
|
+7 |
|
最低化合价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
I、表中①~⑥为部分短周期元素的化合价及原子半径
|
元素性质[ |
元素编号[来源:学*科*网Z*X*X*K] |
|||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
原子半径/nm |
0.102 |
0.110 |
0.074 |
0.075 |
0.071 |
0.099 |
|
最高化合价 |
+6 |
+5 |
|
+5 |
|
+7 |
|
最低化合价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________