题目内容
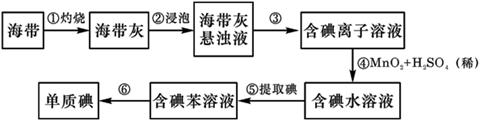
[2012·德州一模](12分)有色金属冶炼厂剩下的废料中,含有金、银、铂、钯等贵重金属,为提高经济效益,某科技小组要从废料中提取金、银、铂、钯等贵重金属,步骤设计如下图甲,试回答下列问题:
(1)实验步骤中,浓硫酸浸煮产生尾气的主要成分是 (填化学式),常用足量NaOH溶液进行尾气处理,发生反应的离子方程式为 。
(2)在实验室中操作I中需要的玻璃仪器有 。
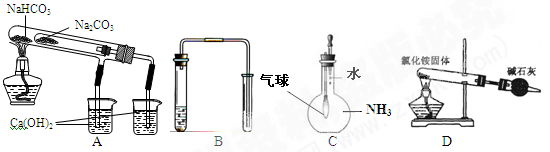
(3)实验过程中所需的氯气在制备中,会混有杂质(H2O和HCl),科技小组设计了图乙所示的实验装置,证明水蒸气和HCl杂质的存在,请根据设计示意图完成下列有关问题:
①A是氯气发生装置,其中发生的离子方程式为 。
②实验装置的接口顺序为:b接 , 接 , 接a。
③装置D的作用是 。
④在实验中,一组员认为该实验设计存在缺陷:不能证明最终通入AgNO3溶液的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,他们提出在某两个装置之间再加装置E。如右图所示。你认为装置E应加在 之间(填装置字母序号),并且在广口瓶中放入 (填写所有试剂或用品名称)。
(1)实验步骤中,浓硫酸浸煮产生尾气的主要成分是 (填化学式),常用足量NaOH溶液进行尾气处理,发生反应的离子方程式为 。
(2)在实验室中操作I中需要的玻璃仪器有 。
(3)实验过程中所需的氯气在制备中,会混有杂质(H2O和HCl),科技小组设计了图乙所示的实验装置,证明水蒸气和HCl杂质的存在,请根据设计示意图完成下列有关问题:
①A是氯气发生装置,其中发生的离子方程式为 。
②实验装置的接口顺序为:b接 , 接 , 接a。
③装置D的作用是 。
④在实验中,一组员认为该实验设计存在缺陷:不能证明最终通入AgNO3溶液的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,他们提出在某两个装置之间再加装置E。如右图所示。你认为装置E应加在 之间(填装置字母序号),并且在广口瓶中放入 (填写所有试剂或用品名称)。

(12分)(1)SO2 SO2+2OH-=SO32-+H2O
(2)(普通)漏斗、玻璃棒、烧杯
(3)①MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
②b接e,f接d,c接a(或b接f,e接d,c接a)
③吸收Cl2
④BD 湿润的KI淀粉试纸(或湿润的有色布条)
(2)(普通)漏斗、玻璃棒、烧杯
(3)①MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O②b接e,f接d,c接a(或b接f,e接d,c接a)
③吸收Cl2
④BD 湿润的KI淀粉试纸(或湿润的有色布条)
(1)浓硫酸浸煮的目的是利用浓硫酸的强氧化性,在加热条件下将不溶于盐酸而溶于浓硫酸的有色金属溶解,浓硫酸被还原为SO2,故尾气的主要成分为SO2;SO2与过量的NaOH溶液反应生成Na2SO3和H2O,该反应的离子方程式为SO2+2OH-=SO32-+H2O。
(2)操作I是过滤,过滤操作中用到的玻璃仪器有(普通)漏斗、玻璃棒、烧杯。
(3)①结合装置A可知,制取Cl2用MnO2和浓盐酸,反应的离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
②首先用装置C检验水蒸气,然后用装置D吸收Cl2,最后用装置B检验HCl气体。
④在D和B之间加入一个装置用来检验在D中氯气是否被完全吸收,可以用湿润的有色布条或湿润的淀粉KI试纸。
(2)操作I是过滤,过滤操作中用到的玻璃仪器有(普通)漏斗、玻璃棒、烧杯。
(3)①结合装置A可知,制取Cl2用MnO2和浓盐酸,反应的离子方程式为MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。②首先用装置C检验水蒸气,然后用装置D吸收Cl2,最后用装置B检验HCl气体。
④在D和B之间加入一个装置用来检验在D中氯气是否被完全吸收,可以用湿润的有色布条或湿润的淀粉KI试纸。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目

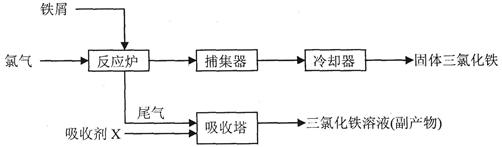
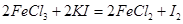 ,用淀粉作指示剂,用
,用淀粉作指示剂,用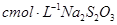 溶液进行滴定
溶液进行滴定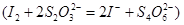 ,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56 Cl:35.5)
,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56 Cl:35.5)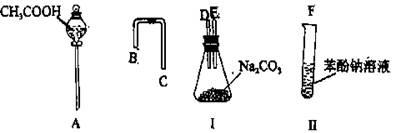
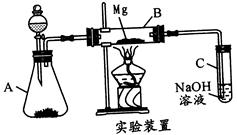
 2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。