题目内容
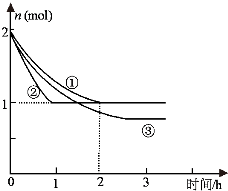 合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-94.2kJ?mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示.
合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-94.2kJ?mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示.请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②
(2)实验①的平衡常数K=
(3)氨是工业合成尿素(H2NCONH2)的重要原料,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g)═H2NCOONH4(氨基甲酸铵)(l)△H1=-330.0kJ?mol-1
第2步:H2NCOONH4(l)═H2O(l)+H2NCONH2(l)△H2=+226.0kJ?mol-1
则2NH3(l)+CO2(g)═H2O(l)+H2NCONH2 (l)△H=
(4)工业上利用反应 3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.当转移6mol 电子时,生成氮气在标准状况下的体积是
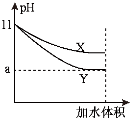
(5)相同pH的氨水和NaOH溶液加水稀释相同的倍数,pH变化曲线如图所示,则x曲线代表的物质是
分析:(1)与①比较,②条件下建立的平衡和①相同,但是化学反应速率加快了,③的化学反应速率减慢,并且平衡时氮气的物质的量变小了,平衡正向移动了;
(2)根据化学平衡常数K=
来计算,根据v=
来计算化学反应速率;
(3)根据盖斯定律来计算化学反应的焓变;
(4)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据化合价变化来分析电子转移情况;
(5)pH的氨水和NaOH溶液加水稀释相同的倍数,强碱的pH变化幅度大,弱碱的变化幅度小,根据氢氧化钠稀释前后pH变化规律来确定体积的变化.
(2)根据化学平衡常数K=
| 各个生成物平衡浓度系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
| △c |
| △t |
(3)根据盖斯定律来计算化学反应的焓变;
(4)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据化合价变化来分析电子转移情况;
(5)pH的氨水和NaOH溶液加水稀释相同的倍数,强碱的pH变化幅度大,弱碱的变化幅度小,根据氢氧化钠稀释前后pH变化规律来确定体积的变化.
解答:解:(1)与①比较,②条件下建立的平衡和①相同,但是化学反应速率加快了,所以改变的条件是加入催化剂,③的化学反应速率减慢,并且平衡时氮气的物质的量变小了,平衡正向移动了,所以改变的条件是降低温度,故答案为:加入催化剂;降低温度;
(2)根据实验①,列三行内容如下:
N2(g)+3H2(g)?2NH3(g)
初始浓度:1 3 0
变化浓度:0.5 1.5 1.0
平衡浓度:0.5 1.5 1.0
化学平衡常数K=
=
=
L2?mol-2,该反应进行到2h时的平均反应速率v(H2)=
=0.75 mol?L-1?h-1,
故答案为:
L2?mol-2;0.75 mol?L-1?h-1;
(3)已知①2NH3(l)+CO2(g)═H2NCOONH4(氨基甲酸铵)(l)△H1=-330.0kJ?mol-1
②H2NCOONH4(l)═H2O(l)+H2NCONH2(l)△H2=+226.0kJ?mol-1,则反应2NH3(l)+CO2(g)═H2O(l)+H2NCONH2 (l)可以是①+②所得,所以该反应的焓变△H=-330.0kJ?mol-1+226.0kJ?mol-1=-104 kJ?mol-1,故答案为:-104kJ?mol-1;
(4)氧化还原反应3Cl2+2NH3═N2+6HCl中,化合价升高值=化合价降低值=转移电子数=6,即当转移6mol 电子时,生成氮气物质的量是1mol,在标准状况下的体积是22.4L,故答案为:22.4;
(5)pH的氨水和NaOH溶液加水稀释相同的倍数,强碱氢氧化钠的pH变化幅度大,弱碱氨水的变化幅度小,所以x曲线代表的物质是氨水,根据氢氧化钠稀释前后,pH变化从9到11,所以稀释了100倍,即稀释后溶液的体积是稀释前溶液体积的100倍,故答案为:氨水;100.
(2)根据实验①,列三行内容如下:
N2(g)+3H2(g)?2NH3(g)
初始浓度:1 3 0
变化浓度:0.5 1.5 1.0
平衡浓度:0.5 1.5 1.0
化学平衡常数K=
| c(NH3)2 |
| c(N2)?c(H2)3 |
| 1.02 |
| 0.5×1.53 |
| 16 |
| 27 |
| 1.5mol/L |
| 2h |
故答案为:
| 16 |
| 27 |
(3)已知①2NH3(l)+CO2(g)═H2NCOONH4(氨基甲酸铵)(l)△H1=-330.0kJ?mol-1
②H2NCOONH4(l)═H2O(l)+H2NCONH2(l)△H2=+226.0kJ?mol-1,则反应2NH3(l)+CO2(g)═H2O(l)+H2NCONH2 (l)可以是①+②所得,所以该反应的焓变△H=-330.0kJ?mol-1+226.0kJ?mol-1=-104 kJ?mol-1,故答案为:-104kJ?mol-1;
(4)氧化还原反应3Cl2+2NH3═N2+6HCl中,化合价升高值=化合价降低值=转移电子数=6,即当转移6mol 电子时,生成氮气物质的量是1mol,在标准状况下的体积是22.4L,故答案为:22.4;
(5)pH的氨水和NaOH溶液加水稀释相同的倍数,强碱氢氧化钠的pH变化幅度大,弱碱氨水的变化幅度小,所以x曲线代表的物质是氨水,根据氢氧化钠稀释前后,pH变化从9到11,所以稀释了100倍,即稀释后溶液的体积是稀释前溶液体积的100倍,故答案为:氨水;100.
点评:本题涉及热化学、化学反应速率和平衡移动的影响因素以及溶液稀释pH的变化规律知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
在四个不同的容器中,分别进行不同条件下的合成氨反应N2(g)+3H2(g)?2NH3(g).在相同时间内表示该反应速率最快的是( )
| A、v(H2)=0.1mol/(L?s) | B、v(N2)=0.1mol/(L?s) | C、v(N2)=0.2mol/(L?s) | D、v(NH3)=0.3mol/(L?s) |
下列说法正确的是( )
| A、对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | B、氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | C、合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | D、25℃Ksp[Al(OH)3]=2×10-33,Ksp(AlPO4)=1.310-20,在各自的饱和溶液中,c(Al3+)前者小 |
 =PtF6-(g)△H2=-771.1kJ?mol-1
=PtF6-(g)△H2=-771.1kJ?mol-1