题目内容
【题目】800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g) ![]() 2NO2(g) n(NO)随时间的变化如表:
2NO2(g) n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO) (mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
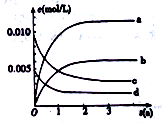
A.a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L·s)
B.800℃时,该反应的平衡常数K=1125L/mol
C.能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分离出NO2
D.已知:K300℃>K350℃,则该反应时吸热反应
【答案】B
【解析】
试题分析:A.a线表示NO2的变化趋势,则0~2s内v(NO)=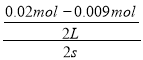 =0.00275mol/(L·s),v(NO2)= v(NO)=0.00275mol/(L·s),故A错误;
=0.00275mol/(L·s),v(NO2)= v(NO)=0.00275mol/(L·s),故A错误;
B、 2NO(g) + O2(g)![]() 2NO2(g)
2NO2(g)
开始浓度 0.01mol/L 0.005mol/L 0
转化浓度 0.006mol/L 0.003mol/L 0.006mol/L
平衡浓度 0.004mol/L 0.002mol/L 0.006mol/L
K=![]() =1125,故B正确;C.分离出NO2,减小了二氧化氮的浓度,反应速率减慢,故C错误;D.已知:K300℃>K350℃,表示升高温度,平衡向逆反应方向移动,则该反应时放热反应,故D错误;故选B。
=1125,故B正确;C.分离出NO2,减小了二氧化氮的浓度,反应速率减慢,故C错误;D.已知:K300℃>K350℃,表示升高温度,平衡向逆反应方向移动,则该反应时放热反应,故D错误;故选B。

练习册系列答案
相关题目
