题目内容
16.下列说法正确的是( )| A. | 0.2mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) | |
| B. | 向NH4Cl溶液中加入少量氨水,当pH=7时,则混合液中:c(NH4+)=c(Cl-) | |
| C. | 0.1mol•L-1的Na2S溶液中:c(Na+)=2c(S2-) | |
| D. | 某溶液的pH为6,则该溶液一定显酸性 |
分析 A.碳酸氢钠溶液呈碱性,说明HCO3-电离程度小于水解程度,HCO3-水解和水电离都生成OH-;
B.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断c(NH4+)、c(Cl-)相对大小;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.不能根据溶液pH判断溶液酸碱性,要根据c(H+)、c(OH-)相对大小判断溶液酸碱性.
解答 解:A.碳酸氢钠溶液呈碱性,说明HCO3-电离程度小于水解程度,但其水解和电离程度都较小,HCO3-水解和水电离都生成OH-,所以存在c(Na+)>c(HCO3-)>c(OH-)>c(CO32-),故A错误;
B.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],故C错误;
D.95℃时纯水pH=6,所以pH=6的溶液不一定呈酸性,故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意电荷守恒、物料守恒的灵活运用,易错选项是D,注意:温度未知时不能根据溶液pH判断溶液酸碱性,为易错点.

练习册系列答案
相关题目
6.下列化学用语表述不正确的是( )
| A. | 水解方程式 HCO${\;}_{3}^{-}$+H2O═H2CO3+H3O+ | |
| B. | 水的电离 2H20?H3O++OH- | |
| C. | 醋酸的电离方程式CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 水解方程式 HCO${\;}_{3}^{-}$+H2O?H2CO3+OH- |
7.下列有关化学用语的表示方法中正确的是( )
| A. | H2O2的电子式: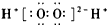 | B. | CO2分子的结构式:O=C=O | ||
| C. | 原子核内有8个中子的碳原子:$\stackrel{14}{8}$C | D. | 氯化钠的分子式:NaCl |
11.下列叙述中,正确的是( )
| A. | G4H10的一种同分异构体只能生成一种一氯代物 | |
| B. | CH3-CH=CH-C≡C-CF3分子结构中6个碳原子不可能都在一条直线上 | |
| C. | 某物质的名称为:2-甲基-3-乙基丁烷 | |
| D. | 制取1,2-二溴乙烷的最合理的方法是乙烯与HBr进行加成反应 |
8.用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),则( )
| A. | c(H+)<c(OH-) | B. | c(CH3COO-)=0.1mol/L-1 | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=0.1mol/L-1 |
5.NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 在标准状况下,22.4L CH4与22.4L H2O所含的电子数均为10NA | |
| B. | 122.5g KClO3晶体中的氯离子总数等于3NA | |
| C. | 常温常压下,总质量为28g的N2和CO的混合气体,其体积大于22.4L | |
| D. | 浓度均为0.5mol/L的盐酸和硫酸的混合溶液中,H+的物质的量为1.5mol |
4.已知热化学方程式:2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1,则关于热化学方程式:2H2O(l)═2H2(g)+O2(g)△H2=?的说法中正确的是( )
| A. | 热化学方程式中化学计量数表示分子数 | |
| B. | 该反应△H2>0 | |
| C. | 该反应的△H2=-571.6 kJ•mol-1 | |
| D. | 该反应可表示36 g水分解时的热效应 |
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置: SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如图所示的实验装置.检验该装置的气密性,先在试管中装入适量的水(保证玻璃导管的下端末在水中),然后(填操作方法)向外轻轻拉动注射器的活塞将会看到(填现象)浸没在水中的玻璃导管口有气泡冒出.则证明该装置气密性良好.
SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如图所示的实验装置.检验该装置的气密性,先在试管中装入适量的水(保证玻璃导管的下端末在水中),然后(填操作方法)向外轻轻拉动注射器的活塞将会看到(填现象)浸没在水中的玻璃导管口有气泡冒出.则证明该装置气密性良好.