��Ŀ����
����Ŀ��Ϊ����������Ӧ���ٶ�������������Ͷ�����̼�����ʵ��ŷ�����
��1����CH4����ԭúȼ�ղ����ĵ����������������Ⱦ��
��֪��CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H=��867.0kJ/mol
NO2��g���T ![]() N2O4��g����H=��28.5kJ/mol
N2O4��g����H=��28.5kJ/mol
д��CH4����ԭN2O4��g������CO2��N2��H2O��g�����Ȼ�ѧ����ʽ ��
��2��һ�������£���NO2��SO2�������1��2���ں��º��ݵ��ܱ������У�����NO2��g��+SO2��g���TSO3��g��+NO��g������÷�Ӧ�ﵽƽ��ʱNO2��SO2�����Ϊ1��5����ƽ�ⳣ��K=������ֵ����
��3����ͼ1��һ����NH3��O2�ѳ�������NO��ԭ������ԭ����NO����ת��ΪH2O�����ѧʽ����������1mol NH3��0.5molO2ʱ����ȥ��NO�ڱ�״���µ����ΪL�� 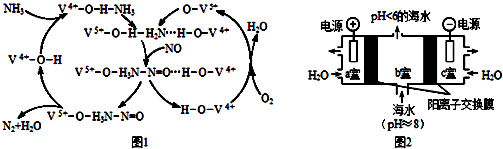
��4���о�CO2�ں����е�ת�ƺ��ޣ��ǵ������ѧ�о���ǰ��������������ͼ2��ʾװ�ã���Ϊ���Ե缫���Ӻ�ˮ����ȡCO2����ˮ����̼95% ��HCO3�����ڣ��������ڼ��ٻ������������庬����
��a�ҵĵ缫��ӦʽΪ ��
��b������ȡCO2�ķ�Ӧ�����ӷ���ʽΪ ��
��b���ų��ĺ�ˮ��pH��6������ֱ���Żش����ø�װ���в��������ʶ�b���ų��ĺ�ˮ���д������ϸ������Żش������ķ�����
���𰸡�
��1��CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g����H=��810kJ/mol
��2��1.8
��3��N2��11.2
��4��2H2O��4e��=4H++O2����H++HCO3��=CO2��+H2O����c���ų��ļ�Һ����b���ų������Ժ�ˮ������װ����ں�ˮ��pH
���������⣺��1����֪����CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H1=��867kJ/mol��2NO2��g��N2O4��g����H2=��57kJ/mol
���ݸ�˹���ɣ����CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g�����ʡ�H=��867kJ/mol������57kJ/mol��=��810kJ/mol��
��CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g������H=��810kJ/mol��
���Դ��ǣ�CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g����H=��810kJ/mol����2��
NO2��g��+ | SO2��g�� | SO3��g��+ | NO��g�� | |
��ʼ�� | a | 2a | ||
�仯�� | x | x | x | x |
ƽ���� | a-x | 2a-x | x | x |
�������֪�� ![]() ����֮�ã�x=
����֮�ã�x= ![]() ������K=
������K= ![]() =1.8�����Դ��ǣ�1.8����3����ͼ1��֪��Ӧ��Ϊ������һ�������Ͱ�������������Ϊ������ˮ������NO����ת��ΪN2��H2O��������һ�������Ͱ�����Ӧ���ɵ�����ˮ����Ӧ�а���ʧȥ�ĵ��ӵ����ʵ�������NO�������õ��ĵ��������ʵ�����1mol NH3ת��ΪN2ʧȥ3mol���ӣ�0.5mol O2�õ�2mol���ӣ���NOת��ΪN2�õ��ĵ���Ϊ1mol������NO�����ʵ���Ϊ0.5mol�������Ϊ11.2L�����Դ��ǣ�N2��11.2����4����a��Ϊ����������������Ӧ���缫����ʽΪ2H2O��4e��=4H++O2�������Դ��ǣ�2H2O��4e��=4H++O2����
=1.8�����Դ��ǣ�1.8����3����ͼ1��֪��Ӧ��Ϊ������һ�������Ͱ�������������Ϊ������ˮ������NO����ת��ΪN2��H2O��������һ�������Ͱ�����Ӧ���ɵ�����ˮ����Ӧ�а���ʧȥ�ĵ��ӵ����ʵ�������NO�������õ��ĵ��������ʵ�����1mol NH3ת��ΪN2ʧȥ3mol���ӣ�0.5mol O2�õ�2mol���ӣ���NOת��ΪN2�õ��ĵ���Ϊ1mol������NO�����ʵ���Ϊ0.5mol�������Ϊ11.2L�����Դ��ǣ�N2��11.2����4����a��Ϊ����������������Ӧ���缫����ʽΪ2H2O��4e��=4H++O2�������Դ��ǣ�2H2O��4e��=4H++O2����
��������ͨ�������ӽ���Ĥ����b�ң�������Ӧ��H++HCO3��=CO2��+H2O�����Դ��ǣ�H++HCO3��=CO2��+H2O��
��c�ҷ���2H2O+2e��=2OH��+H2��������c���ų��ļ�Һ����b���ų������Ժ�ˮ������װ����ں�ˮ��pH���Դﵽ�ŷű���
���Դ��ǣ���c���ų��ļ�Һ����b���ų������Ժ�ˮ������װ����ں�ˮ��pH��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ�ⳣ���ĺ���(ָ��һ�������µĿ��淴Ӧ�����Ӧ���淴Ӧ��������ȣ���Ӧ������и���ֵ�Ũ�Ȳ����״̬)����Ҫ���ջ�ѧƽ��ļ���(��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%)�����֪ʶ���Ǵ���Ĺؼ���

 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�