题目内容
【题目】(化学——选修3:物质结构与性质)
氮元素的单质及其化合物在科研、生产领域有着十分广泛的用途。回答下列问题:
(1)GaN是研制微电子器件、光电子器件的新型半导体材料,基态氮原子的核外具有__________种不同能量的电子;基态镓原子的核外电子排布式为__________。
(2)在硫酸铜溶液中加入过量氨水,得到深蓝色透明溶液,该溶液中存在![]() ,其中提供孤电子对的原子是__________,该配离子的结构可表示为__________。
,其中提供孤电子对的原子是__________,该配离子的结构可表示为__________。
(3)![]() 是一种重要的化工原料,可以制硝酸、化肥、硝酸盐,液态时可以做制冷剂。
是一种重要的化工原料,可以制硝酸、化肥、硝酸盐,液态时可以做制冷剂。![]() 分子中氮原子的杂化轨道类型为__________,氨气易液化的原因是____________________。
分子中氮原子的杂化轨道类型为__________,氨气易液化的原因是____________________。
(4)氮化硼是一种有着广泛用途的新型材料,主要结构有立方氮化硼和六方氮化硼两种。
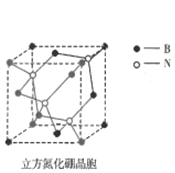

①立方氮化硼具有很高的硬度,仅次于金钢石,其晶体类型属于__________晶体,立方氮化硼中氮原子的配位数为__________。
②已知六方氮化硼同层中B与N原子核之间的距离为a cm,相邻层与层之间的距离为b cm,则该晶体的密度的计算式为__________![]() (用含a、b、
(用含a、b、![]() 的代数式表示)。
的代数式表示)。
【答案】3 [Ar]3d104s24p1 N  sp3 氨气分子间不只存在范德华力,还存在氢键,沸点比一般气体高,容易被液化 原子 4
sp3 氨气分子间不只存在范德华力,还存在氢键,沸点比一般气体高,容易被液化 原子 4 ![]()
【解析】
(1)相同能级上的电子具有相同的能量;根据构造原理书写基态镓原子的核外电子排布式;
(2)配合物中,配体提供孤电子对,中心原子提供空轨道形成配位键;
(3)![]() 分子中氮原子的价电子对数是
分子中氮原子的价电子对数是![]() ,氨气分子间存在氢键;
,氨气分子间存在氢键;
(4)①根据立方氮化硼硬度高分析晶体类型;根据立方氮化硼的晶胞图,离氮原子最近的B原子有4个;②根据![]() 计算;
计算;
(1)N原子核外电子排布在1s、s2、sp三个能级上,所以有3种不同能量的电子;镓原子核外电子数是31,核外电子排布式[Ar]3d104s24p1;
(2)![]() 中Cu2+是中心原子,提供空轨道,NH3是配体,N原子提供孤电子对;Cu2+通过4个配位键与4个NH3结合,该配离子的结构可表示为
中Cu2+是中心原子,提供空轨道,NH3是配体,N原子提供孤电子对;Cu2+通过4个配位键与4个NH3结合,该配离子的结构可表示为 ;
;
(3)![]() 分子中氮原子的价电子对数是
分子中氮原子的价电子对数是![]() ,氮原子的杂化轨道类型为sp3;氨气分子间不只存在范德华力,还存在氢键,沸点比一般气体高,容易被液化;
,氮原子的杂化轨道类型为sp3;氨气分子间不只存在范德华力,还存在氢键,沸点比一般气体高,容易被液化;
(4)①立方氮化硼硬度高,所以属于原子晶体;根据立方氮化硼的晶胞图,离氮原子最近的B原子有4个,氮原子的配位数为4;
②根据均摊原则,1个晶胞中B原子的数目是![]() 、N原子的数目是
、N原子的数目是![]() ;晶胞的体积是
;晶胞的体积是![]() ,根据
,根据![]() =
=![]()
![]() 。
。


