题目内容
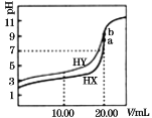
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( )
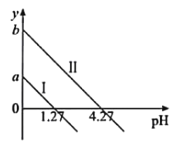
A.已知室温下某碱AOH的Kb=1×10-9,则AY的水溶液呈碱性
B.当加入10.00mL NaOH溶液时,有c(Na+)>c(HX)> c(X-)> c(H+)
C.pH=7时,c(Y-)=c(X-)
D.a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
【答案】D
【解析】
A.室温下HY的Ka=![]() =1×10-5,某碱AOH的Kb = 1×10-9,则Ka> Kb ,AY的水溶液呈酸性,A错误;
=1×10-5,某碱AOH的Kb = 1×10-9,则Ka> Kb ,AY的水溶液呈酸性,A错误;
B.当加入10.00 mL NaOH溶液时,溶液为等浓度的HX、NaX溶液,溶液的pH<5,则以HX的电离为主,从而得出c(X-)>c(Na+)> c(HX)> c(H+),B错误;
C.从图中可能看出,pH=7时,HY消耗NaOH的物质的量少,则c(Y-)<c(X-),C错误;
D.a、b两点,酸与碱刚好完全反应,溶质分别为NaX和NaY,溶液中存在以下水解和电离:X-+H2O![]() HX+OH-、Y-+H2O
HX+OH-、Y-+H2O![]() HY+OH-、H2O
HY+OH-、H2O![]() H++OH-,所以混合后,c(HX)+ c(HY)+ c(H+)= c(OH-),D正确;
H++OH-,所以混合后,c(HX)+ c(HY)+ c(H+)= c(OH-),D正确;
故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目