题目内容
【题目】NO、NO2是大气污染物,但只要合理利用也是重要的资源。
(1)NH3还原法可将NO2还原为N2进行脱除。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H1=-1530 kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+180 kJ·mol-1
写出NH3还原NO的热化学方程式:_________________________________________。
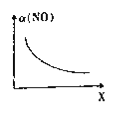
(2)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
a.温度 b.压强 c.![]() d.与催化剂的接触面积
d.与催化剂的接触面积
(3)在密闭容器中充入4 mol CO和5 mol NO,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
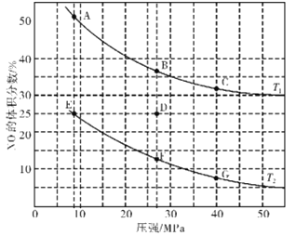
①温度:T1_______(填“<”或“>”)T2。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,重新达到平衡,则D点应向图中A~G点中的_______点移动。
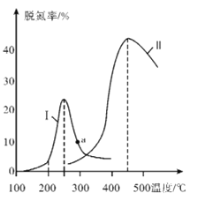
③某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为____________;a点_______(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由:___________________________________。
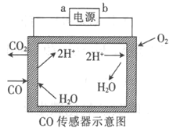
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法处理燃煤烟气中的NO,装置如图4所示:

①阴极区的电极反应式为______________________________________。
②NO被吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上被吸收的NO在标准状况下的体积为____________mL。
【答案】4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-2070kJmol-1 ac > A 温度较低时,催化剂的活性偏低 不是 因为该反应为放热反应,根据线Ⅱ可知,a点对应温度的平衡脱氮率应该更高 2SO32-+4H++2e-=S2O42-+2H2O 1344
【解析】
(1) NH3还原NO反应的方程式为4NH3+6NO=5N2+6H2O,①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-1530kJmol-1,②N2(g)+O2(g)═2NO(g)△H2=+180kJmol-1,根据盖斯定律①-②×3得到NH3还原NO反应的热化学方程式;
(2) 如图所示NO的转化率a(NO)随X的增量而逐渐减小,说明平衡逆向移动;
(3)①根据反应2CO(g)+2NO(g)N2(g)+2CO2(g)判断,升高温度,平衡向吸热方向移动;
②对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加;
③催化剂在低温下活性不大,反应随温度变化速率变化不大,图象分析可知a点不是对应温度下的平衡脱氮率;
(4) 由图可知,阴极上亚硫酸根离子得到电子生成S2O42-,NO吸收转化后的主要产物为NH4+,N元素的化合价由+2价降低为-3价,以此计算。
(1) NH3还原NO反应的方程式为4NH3+6NO=5N2+6H2O,①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-1530kJmol-1,②N2(g)+O2(g)═2NO(g)△H2=+180kJmol-1,由盖斯定律①-②×3有4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1530kJmol-1-(+180kJmol-1)×3=-2070kJmol-1,则NH3还原NO的热化学方程式为4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-2070kJmol-1;
(2) 如图所示NO的转化率a(NO)随X的增量而逐渐减小,说明平衡逆向移动;
a.反应2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,则升高温度,平衡逆向移动,NO的转化率减小,与图象吻合,故a正确;
2ClNO(g) △H<0,则升高温度,平衡逆向移动,NO的转化率减小,与图象吻合,故a正确;
b.反应2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,则增大压强,平衡正向移动,NO的转化率增大,与图象不吻合,故b错误;
2ClNO(g) △H<0,则增大压强,平衡正向移动,NO的转化率增大,与图象不吻合,故b错误;
c.![]() 增大,说明是增减小Cl2的量或增大NO的量,NO的转化率均减小,与图象吻合,故c正确;
增大,说明是增减小Cl2的量或增大NO的量,NO的转化率均减小,与图象吻合,故c正确;
d.改变催化剂的接触面积,不影响平衡的移动,NO的转化率不变,与图象不吻合,故d错误;
故答案为ac;
(3)①根据反应2CO(g)+2NO(g)N2(g)+2CO2(g)△H=-746kJmol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2;
②若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点;
(3)图象分析可知a点不是对应温度下的平衡脱氮率:温度较低时,催化剂的活性偏低;不是平衡脱氮率,因为该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高;
(4)①由图可知,阴极上亚硫酸根离子得到电子生成S2O42-,阴极区的电极反应式为2SO32-+4H++2e-=S2O42-+2H2O;
②NO吸收转化后的主要产物为NH4+,N元素的化合价由+2价降低为-3价,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为![]() ×22.4L/mol=1.344L=1344mL。
×22.4L/mol=1.344L=1344mL。