题目内容
8. 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-═2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-═2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:(1)将反应Zn+2H+═Zn2++H2↑拆写为两个“半反应式”:其中,氧化反应式为:Zn-2e-=Zn2+.
(2)由题(1)反应,设计成原电池如图所示:
若电极a为Zn,电极b可选择材料:铜(只填一种);电解质溶液甲是ZnSO4;电极b处的电极反应式为:H++2e-=H2↑.
(3)利用CH4燃烧原理,CH4可用于制造燃料电池,电池的电解质溶液是KOH溶液,其负极反应为:CH4+10OH--8e-=CO32-+7H2O,放电时溶液中的OH-向负极移动,如果消耗标准状况下5.6L的甲烷,转移电子的物质的量为2mol.
分析 (1)失电子的物质发生氧化反应;
(2)将反应Zn+2H+═Zn2++H2↑,若电极a为Zn,电极b为不如锌活泼的金属或导电的非金属,电极和相应的电解质溶液含有相同的阳离子,正极上得电子发生还原反应;
(3)负极上燃料甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,正负极反应式分别为:2H2O+O2+4e-=4OH-、CH4+10OH--8e-=CO32-+7H2O,结合电解方程式解答.
解答 解:(1)根据方程式知,锌失电子发生氧化反应,所以其反应式为:Zn=Zn2++2e-,
故答案为:Zn-2e-=Zn2+;
(2)反应Zn+2H+═Zn2++H2↑,若电极a为Zn,电极b为不如锌活泼的金属或导电的非金属,如铜等,电极和相应的电解质溶液含有相同的阳离子,可以是硫酸锌溶液,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:铜;ZnSO4;H++2e-=H2↑;
(3)该燃料电池中,负极上燃料甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极方程式为CH4+10OH--8e-=CO32-+7H2O,阴离子向负极移动,如果消耗标准状况下5.6L的甲烷,n(CH4)=$\frac{5.6L}{22.4L/mol}$=0.25mol,由电极方程式可知转移电子的物质的量为2mol,
故答案为:CH4+10OH--8e-=CO32-+7H2O;负;2mol.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,明确各个电极上发生的反应是解本题关键,所有的燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,难点是电极反应式的书写.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列几种化学电池中,不属于可充电电池的是( )
| A. | 碱性锌锰电池 | B. | 手机用锂电池 | C. | 汽车用铅蓄电池 | D. | 玩具用镍氢电池 |
19.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | NH3的结构式为: | ||
| C. | CH4 分子的比例模型: | D. | -CH3(甲基)的电子式为: |
16.用下列装置不能达到有关实验目的是( )
| A. |  用图装置电解精炼铝 用图装置电解精炼铝 | |
| B. |  用图装置制备Fe(OH)2 用图装置制备Fe(OH)2 | |
| C. |  用图装置可制得金属锰 用图装置可制得金属锰 | |
| D. |  用图装置验证NaHCO3和Na2CO3的热稳定性 用图装置验证NaHCO3和Na2CO3的热稳定性 |
3.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素B的原子最外层电子数是其电子层数的3倍,元素A的价电子数比B少2,元素D与A同主族,元素C与E形成的化合物CE是厨房常用调味品:下列说法正确的是( )
| A. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| B. | 原子半径:C>D>A>B | |
| C. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 | |
| D. | C与B形成的两种化合物中化学键类型完全相同 |
13.关于右边一组图示的说法中错误的是( )
| A. |  用图实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  用图实验可用于比较铝、铁的金属性的强弱 | |
| C. |  图表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 | |
| D. | 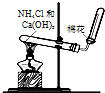 图装置可用于实验室制取氨气 |
18.1mL密度为0.93g•cm-3的氨水恰好中和0.005mol H2SO4生成(NH4)2SO4,若要配制上述浓度的氨水,在1L水中需要溶解标准状况下的氨气( )
| A. | 294.7L | B. | 378.0L | C. | 2240.0L | D. | 1120.0L |

