题目内容
常温,下列气体不能共存且发生的反应属于非氧化还原的是
| A.NO和O2 | B.SO2和H2S |
| C.NH3和HCl | D.Cl2和SO2 |
C
解析试题分析:A.2NO+O2= 2NO2.不能共存,发生的是氧化还原反应。错误。B.SO2+2H2S=3S++2H2O.不能共存,发生的是氧化还原反应。错误。C.NH3+HCl= C.NH4Cl。不能共存,发生的是非氧化还原反应。正确。D.Cl2和SO2在无水时可以大量共存。错误。
考点:考查气体能否大量共存及发生的化学反应类型的知识。

今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.HCl | D.FeCl3 |
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
①NH4+(aq) + 3/2O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
②NO2-(aq) + 1/2O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
| A.升高温度,可使①②反应速率均加快 |
| B.室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性 |
| C.NH4+(aq) + 2O2(g) = NO3 -(aq) + 2H+(aq) + H2O(l)ΔH = -346kJ/mol |
| D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3 |
有Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为
| A.1:6 |
| B.2:15 |
| C.2:11 |
| D.1:7 |
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是
| A.SO2只是氧化产物 |
| B.CuFeS2仅作还原剂,硫元素被氧化 |
| C.每生成1molCu2S,有4mol硫被氧化 |
| D.每转移1.2mol电子,有0.2mol硫被氧化 |
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
| A.NaBH4既是氧化剂又是还原剂 |
| B.NaBH4是氧化剂,H2O是还原剂 |
| C.硼元素被氧化,氢元素被还原 |
| D.被氧化的元素与被还原的元素质量之比为1∶1 |
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
C.氧化性:MnO2>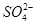 > > >I2 >I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1∶5 |
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是 ( )。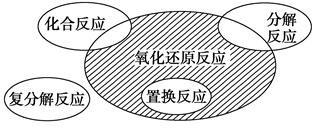
| A.Cl2+2KBr=Br2+2KCl |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |