题目内容
【题目】研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是( )
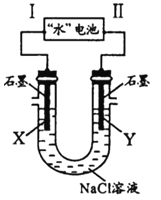
A.I为负极,其电极反应式为Ag+Cl-+e-=AgCl
B.“水”电池内Na+不断向负极作定向移动
C.每转移1mole-,U型管中消耗0.5molH2O
D.“水”电池内,每生成1molNa2Mn5O10,X电极上生成1mol气体
【答案】D
【解析】
试题分析:A.X电极上有无色气体逸出,应为阴极,生成氢气,则Ⅰ为负极,根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物,则负极发生Ag+Cl--e-=AgCl,故A错误;B.原电池工作时,阳离子向正极移动,所以“水”电池内Na+不断向正极作定向移动,故B错误;C.每转移1mole-,由2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,可知生成0.5mol氢气,消耗1mol水,故C错误;D.方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,又X电极上有无色气体逸出,即电极反应为2H2O+2e-=2OH-+H2↑,所以X电极上生成1 mol气体,故D正确。故选D。
2OH-+H2↑+Cl2↑,可知生成0.5mol氢气,消耗1mol水,故C错误;D.方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,又X电极上有无色气体逸出,即电极反应为2H2O+2e-=2OH-+H2↑,所以X电极上生成1 mol气体,故D正确。故选D。

练习册系列答案
相关题目