题目内容
将2molNaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃时所得气体中仅含有两种组分,则反应后固体的物质的量n的取值范围是
| A.n=1mol | B.1mol<n<2mol | C.2mol<n<4mol | D.n≥4mol |
C
2NaHCO3===Na2CO3+CO2↑+H2O↑;2molNaHCO3生成1mol CO2和1mol H2O、1mol Na2CO3,Na2O2固体与混合气体反应可看成是先与CO2反应,反应完后再与H2O反应。
2Na2O2+2CO2="2" Na2CO3+ O2↑;2Na2O2+2 H2O ="4NaOH+" O2↑;要求反应后气体中含有两种组分,则两组分为氧气和水蒸气;过氧化钠与二氧化碳反应消耗的物质的量为1mol,生成Na2CO3的物质的量为1mol,若1mol H2O全部与Na2O2反应则生成2 mol NaOH,所以反应后固体的物质的量n的取值范围是2mol<n<4mol;
2Na2O2+2CO2="2" Na2CO3+ O2↑;2Na2O2+2 H2O ="4NaOH+" O2↑;要求反应后气体中含有两种组分,则两组分为氧气和水蒸气;过氧化钠与二氧化碳反应消耗的物质的量为1mol,生成Na2CO3的物质的量为1mol,若1mol H2O全部与Na2O2反应则生成2 mol NaOH,所以反应后固体的物质的量n的取值范围是2mol<n<4mol;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

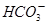 )为
)为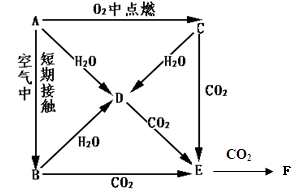
 能使NaNO2中的氮转化为对空气无污染的气体,该物质是
能使NaNO2中的氮转化为对空气无污染的气体,该物质是