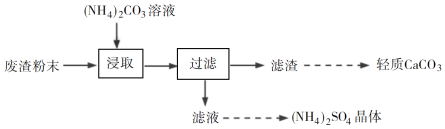
题目内容
【题目】下表是一些键能数据![]() :
:

回答下列问题。
(1)由表中数据能否得出下列结论:
①半径越小的原子形成的共价键越牢固(即键能越大),__________(填“能”或“不能”);
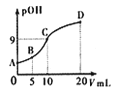
②非金属性越强的原子形成的共价键越牢固,__________(填“能”或“不能”)。能否从数据中找出一些规律,请写出一条:______________________________。试预测C-Br键的键能范围:__________<C-Br键能<__________。
(2)由热化学方程式![]()
![]() 并结合上表数据可推知一个化学反应的反应热(设反应物和生成物均为气态)与反应物和生成物的键能之间的关系是_____________;
并结合上表数据可推知一个化学反应的反应热(设反应物和生成物均为气态)与反应物和生成物的键能之间的关系是_____________;
(3)由热化学方程式![]()
![]() 和表中数值可计算出
和表中数值可计算出![]() 变为
变为![]() 时将__________(填“吸收”或“放出”)__________kJ的热量。
时将__________(填“吸收”或“放出”)__________kJ的热量。
【答案】不能 不能 与相同原子结合时同主族元素原子形成的共价键,原子半径越小,共价键越牢固 ![]()
![]() 化学反应的反应热等于反应物的键能之和与生成物的键能之和的差 吸收 36.5
化学反应的反应热等于反应物的键能之和与生成物的键能之和的差 吸收 36.5
【解析】
(1)比较半径与键能大小要在同一标准下进行,否则没有可比性,同主族元素的半径越大,键能越小;
(2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差计算解答(2)和(3)。
(1)①由表中数据可知,原子半径F>H,但键能:H-F>H-H,则不能得出半径越小的原子形成的共价键越牢固的结论;②Cl的非金属性大于H,但键能H-H>Cl-Cl,也不能说明非金属性越强的原子形成的共价键越牢固;由H-F、H-Cl、H-Br、H-I的键能可以看出,与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越牢固;Br的原子半径介于Cl与I之间,C-Br的键能介于C-Cl与C-I之间,即216kJmol-1~339 kJmol-1之间,故答案为:不能;不能;与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越牢固;216kJmol-1;339 kJmol-1;
(2)已知:热化学方程式H2(g)+Cl2(g)→2HCl(g) △H=-183kJmol-1,
可得出△H=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,则有化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,故答案为:化学反应的反应热等于反应物的键能之和与生成物的键能之和的差;
(3)由表中数据可得:①2H2(g)+S2(g)→2H2S(g)![]() ,又知②2H2(g)+S2(s)→2H2S(g) △H=-224.5kJmol-1,则②-①得:S2(s)→S2(g) △H=-224.5kJmol-1—(-261kJmol-1)=+36.5kJ/mol,则1mol S2(s)气化时将吸收36.5kJ的能量,故答案为:吸收;36.5。
,又知②2H2(g)+S2(s)→2H2S(g) △H=-224.5kJmol-1,则②-①得:S2(s)→S2(g) △H=-224.5kJmol-1—(-261kJmol-1)=+36.5kJ/mol,则1mol S2(s)气化时将吸收36.5kJ的能量,故答案为:吸收;36.5。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案